Termine
18.12.2024
MedTech-Telegram
In jeder Sitzungswoche informiert die ZVEI-Infografik „MedTech-Telegram“ in kurzer prägnanter Form über Kernaspekte und wichtige Entwicklungen der Branche.
MedTech-Telegram 2024
MTT Folge 123: Das deutsche Gesundheitssystem braucht die Effizienzwende – jetzt!

Die industrielle Gesundheitswirtschaft (iGW) ist eine Schlüsselbranche für Deutschland: Sie trägt 11 % zum BIP bei, sichert 6,6 Millionen Arbeitsplätze und wächst jährlich um 4 % in der Wertschöpfung. Mit Blick auf die alternde Gesellschaft und die zunehmende Bedeutung chronischer Erkrankungen ist sie unverzichtbar – doch Bürokratie und widersprüchliche oder unklare Regeln bremsen sie aus.
Jetzt handeln:
Regeln klären: Der AI Act und die Medical Device Regulation (MDR) dürfen keine Doppelbelastung schaffen. Ein in sich schlüssiges Verfahren muss ausreichen und kann dazu beitragen, Innovationen zu fördern statt zu blockieren.
Telemedizin vorantreiben: Digitale Gesundheitslösungen verbessern die Versorgung in ländlichen Regionen, entlasten das Gesundheitssystem und senken Emissionen durch kürzere Wege.
Die iGW braucht verlässliche und eindeutige Rahmenbedingungen sowie gezielte Förderung. Die Effizienzwende stärkt Wachstum, Wettbewerbsfähigkeit und die Gesundheitsversorgung in Deutschland!
MTT Folge 122: Forschung und Entwicklung in der Medizintechnik am Standort Deutschland halten

Die Gesundheitswirtschaft erringt ihre Leistungskraft neben den starken Produktivfaktoren in Deutschland vor allem aus ihren Investitionen im Bereich der Forschung und Entwicklung. Nach Angaben aus der Gesundheitswirtschaftlichen Gesamtrechnung (GGR) wuchsen diese Ausgaben in der letzten Dekade um 31%, was einer jährlichen Steigerung von gut 3% entspricht. Übertroffen werden diese beachtlichen Veränderungsraten laut GGR aus dem Teilbereich der Medizintechnik mit kumuliert sogar 39%, was in jedem Jahr einem Plus von 3,7% entspricht.
Die Erfolge auf den internationalen Märkten stehen insbesondere in der medizintechnischen Industrie in Zusammenhang mit den F&E-Aktivitäten. Neben der Wettbewerbsfähigkeit im Ausland gilt es aber auch, die Forschung und die Produktion am Standort Deutschland zu halten. Dazu gehört eine zügige und breite Anwendung innovativer Technologien im deutschen Gesundheitssystem. Wichtige Hemmnisse liegen hier in den komplexen Vergütungssystemen der Versorgungsbereiche und der Beherrschung der GKV-Regelungen.
Folge 121: Gesundheitswirtschaft ist ein Motor für Beschäftigung

Die Gesundheitswirtschaft leistet neben ihrem Beitrag für die Gesundheit und somit der Arbeitsfähigkeit der deutschen Bevölkerung auch einen nachhaltigen Beschäftigungsaufbau. Während der letzten zehn Jahre stieg die Anzahl der in der Gesundheitswirtschaft beschäftigten Personen laut Gesundheitswirtschaftlicher Gesamtrechnung (GGR) um 23 Prozent, was einer jährlichen Wachstumsrate von 2,2 Prozent entspricht. Demgegenüber fiel das Beschäftigungsplus in der Gesamtwirtschaft zeitgleich mit kumuliert 7,6% und jährlich zusätzlichen 0,8% deutlich niedriger aus. Dies entspricht einem langfristigen Trend.
Die deutsche Gesundheitswirtschaft samt besonders starker Zweige wie der Medizintechnik wirkt somit auch auf den Arbeitsmarkt hierzulande stabilisierend. Der Standort Deutschland ist für Fachkräfte in vielen Bereichen der Gesundheitswirtschaft, sei es in der Industrie, der Forschung oder der Versorgung, ein Anzugspunkt. Die Politik sollte daher die finanziellen und rechtlichen Rahmenbedingungen für diese Berufsfelder attraktiv halten und verbessern.
Folge 120: Bundesländer im Süden und Westen besonders stark bei Export von Medizinprodukten und der iGW

Die industrielle Gesundheitswirtschaft (iGW) ist auch durch ihre Erfolge in den Auslandsmärkten ein Stabilisator der deutschen Volkswirtschaft. Dies gilt in besonderer Weise für die Medizintechnik, die etwa zwei Drittel ihrer Umsätze im Export erzielt.
Schaut man sich 2022 die Ausfuhr der iGW (149 Mrd. Euro) und der Medizinprodukte (inkl. Medizintechnik, 33 Mrd. Euro) gestaffelt nach Bundesländern an, so entfallen in beiden Aggregaten allein auf Baden-Württemberg, Bayern und Nordrhein-Westfalen rund 60% der Gesamtausfuhr Deutschlands. Vierter in beiden Rankings ist Hessen.
Folge 119: Infrastruktur der Gesundheitsversorgung jetzt über KHVVG umfassend modernisieren

Die Krankenhausreform in Deutschland ist ein entscheidender Schritt sein, um die Gesundheitsversorgung zukunftsfähig zu gestalten und besser an den Bedürfnissen der Patientinnen und Patienten auszurichten. Dafür müssen Krankenhäuser die Chance bekommen, moderne Technologien stärker einzusetzen und Innovationen schneller in die Praxis umzusetzen. Der ZVEI fordert daher eine umfassende Modernisierung der medizintechnischen Infrastruktur, die als Grundlage für eine spezialisierte und vernetzte Krankenhauslandschaft dient. Mit moderner Medizintechnik und digitalen Systemen lassen sich effizientere Arbeitsabläufe und innovative Behandlungsformen realisieren, die besonders mit Blick auf den demografischen Wandel dringend nötig sind. So könnte auch bei sinkendem medizinischem Personal die wachsende Anzahl an Behandlungen, etwa von Krebs- und Herz-Kreislauf-Erkrankungen, bewältigt werden.
Außerdem ist ein langfristiges Investitionsprogramm notwendig, um die Medizintechnik nachhaltig zu modernisieren und gleichzeitig den Ressourcenverbrauch zu senken. Durch den Einsatz intelligenter Systeme könnten nicht nur die Geräte effizienter genutzt, sondern auch das Personal entlastet und die Lebensdauer der Technologie verlängert werden. Um den medizinischen Fortschritt dauerhaft zu sichern, fordert der ZVEI die Einbindung von Wissenschaft und Industrie in die Weiterentwicklung der medizinischen Leistungsgruppen. Zudem müsse die Finanzierung der Krankenhausmodernisierung auf eine tragfähige Basis gestellt werden. Die finanzielle Unterstützung dürfe nicht auf den engen Rahmen des Transformationsfonds begrenzt bleiben, da nur so die flächendeckende, zukunftssichere Versorgung gewährleistet werden k
Folge 118: Medizintechnik ist bedeutendster Bereich innerhalb der iGW für die Bruttowertschöpfung

Nach den Daten der GGR für das Jahr 2023 ist die Medizintechnik innerhalb der industriellen Gesundheitswirtschaft (iGW) der bedeutendste Bereich für die Wertschöpfung am Standort Deutschland. Mit insgesamt 35,1 Mrd. Euro lagen Medizintechnik&Prothetik vor dem Bereich Humanarzneimittel mit 29,5 Mrd. Euro. Innerhalb der drei unterschiedenen Ausstrahleffekte war die Differenz bei den indirekten Effekten mit 12,5 Mrd. Euro gegenüber 8,6 Mrd. Euro besonders groß. Mit lediglich 2,3 Mrd. Euro Wertschöpfung liegt bei digitaler Medizintechnik noch ein hohes Entwicklungspotenzial, was dem erkennbaren Rückstand Deutschlands in der digitalen Transformation des Gesundheitssystems entspricht.
Folge 117: Gesundheitswirtschaft stabilisiert deutsche Bruttowertschöpfung
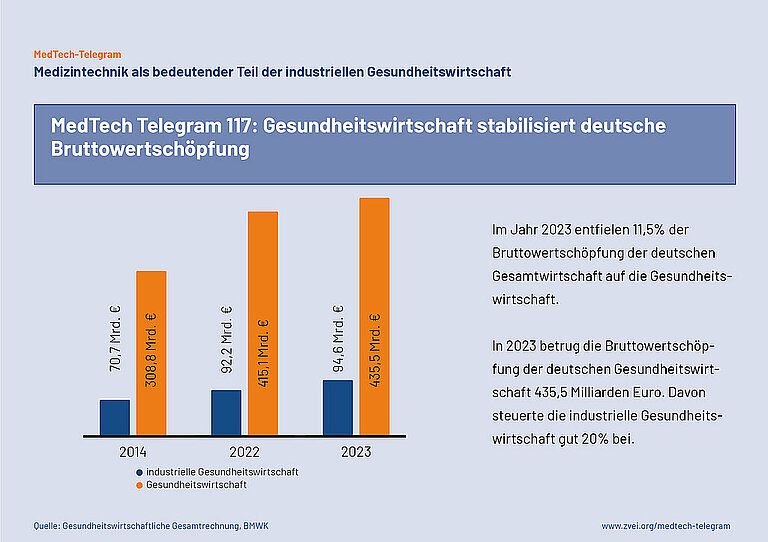
Das Bundeswirtschaftsministerium (BMWK) hat die neuesten Zahlen zur deutschen Gesundheitswirtschaft (GW) veröffentlicht. Laut der Gesundheitswirtschaftlichen Gesamtrechnung ist die Branche in den letzten zehn Jahren kontinuierlich gewachsen. Im Jahr 2023 erzielte die GW eine Wertschöpfung von 435,5 Milliarden Euro. Das entspricht 11,5 Prozent der Bruttowertschöpfung der Gesamtwirtschaft Deutschlands (3.770,6 Mrd. €). 2023 waren laut BMWK fast 8,3 Millionen Erwerbstätige in der GW beschäftigt, das sind 18,1 Prozent aller Erwerbstätigen in Deutschland. Die Bruttowertschöpfung der GW ist in den letzten 10 Jahren etwa in gleichem Maße gewachsen wie das BIP.
Die industrielle Gesundheitswirtschaft (iGW) - vor allem Medizintechnik, Pharmazeutika und Biotechnologie - trägt mit 94,6 Mrd. € über 20 Prozent der Bruttowertschöpfung der GW insgesamt bei. Im Vergleich zu 2022 ist die Branche um 2,9 Prozent gewachsen. Seit 2014 verzeichnete die iGW ein stetiges Wachstum. In den letzten zehn Jahre wuchs sie um 33,7 Prozent.
Folge 116: Letzter Stichtag MDR verstrichen - Erste Medizinprodukte werden vom Markt verschwinden
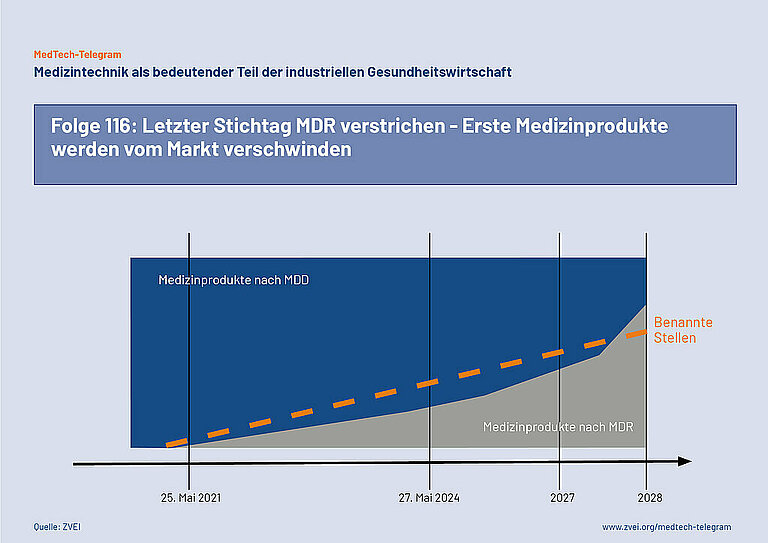
Am 24. Mai 2024 ist der letzte Stichtag für die Umstellung von Bestandsprodukten auf die EU-Verordnung für Medizinprodukte (MDR) verstrichen. Medizinprodukte, die eine CE-Kennzeichnung nach der früher geltenden EU-Richtlinie über Medizinprodukte (MDD) tragen, dürfen nur noch dann weiter in Verkehr gebracht werden, wenn die neue Konformitätsbewertung nach der MDR bereits begonnen hat oder dazu eine schriftliche Vereinbarung mit einer Benannten Stelle besteht. Andere Medizinprodukte dürfen nur noch mit einer CE-Kennzeichnung nach der jetzt geltenden MDR in Verkehr gebracht werden. Damit werden zahlreiche Bestandsprodukte jetzt vom Markt verschwinden.
Wie viele Medizinprodukte davon betroffen sind, wird erst in den kommenden Monaten erkennbar werden. Im März 2023 hat die EU die MDR wegen der Engpässe bei den Benannten Stellen ein letztes Mal geändert. Medizinprodukte mit einer CE-Kennzeichnung nach der früher geltenden EU-Richtlinie über Medizinprodukte (MDD) dürfen danach unter bestimmten Bedingungen noch bis zum Jahr 2027 oder 2028 weitervermarktet. Der Stichtag bis zu dem für diese Bestandsprodukte eine erneute Konformitätsbewertung nach der MDR entweder begonnen wurde oder verbindlich vereinbart wurde, ist am 24. Mai 2024 abgelaufen.
Folge 115: Gesundheitsversorgung mit KHVVG bedarfsgerecht aufstellen

Die öffentliche Veranstaltung "Kompass Gesundheit" verdeutlichte die große Bedeutung, die der ZVEI der geplanten Krankenhausreform in Deutschland zuschreibt. Hierbei betonte der ZVEI besonders die Notwendigkeit, die Gesundheitsversorgung bedarfsgerecht auszurichten und dabei in den Krankenhäusern die technologischen Möglichkeiten stark zu nutzen. Eine moderne medizintechnische Infrastruktur wurde dabei als essenzielles Element einer vernetzten Gesundheitsinfrastruktur hervorgehoben. Während der Diskussion auf der Veranstaltung wurde deutlich, dass das KHVVG vor dem Hintergrund des wachsenden Fachkräftemangels auch Chancen bietet. Dabei spielen moderne medizintechnische Geräte und IT-Systeme eine Schlüsselrolle, da sie effiziente Arbeitsabläufe und innovative medizinische Methoden ermöglichen. Der ZVEI wird sich weiterhin aktiv dafür einsetzen, dass diese Aspekte in die Umsetzung der Krankenhausreform einfließen und ausreichend berücksichtigt werden.
Folge 114: Moderne Nuklearmedizin? „Goldene Regel“ für PET-Altersstruktur wird verfehlt!

Die Positronen-Emissions-Tomographie (PET) ermöglicht im Bereich nuklearmedizinischer Versorgung immer bessere Untersuchungsergebnisse und damit eine zielgenauere Behandlung und Linderung schwerer und verbreiteter Leiden. Besonders bei den Volkskrankheiten Demenzen und Krebserkrankungen konnten in den letzten Jahren große Fortschritte erzielt werden. Eine moderne Ausstattung des Gesundheitssystems mit breitem Patienten-Zugang zu neuen Technologien ist zur Erreichung dieser Ziele unabdingbar.
Der europäische Dachverband für Hersteller elektromedizinischer Systeme COCIR fordert für eine sachgerechte Versorgung eine Altersstruktur für installierte Systeme, bei der 60% jünger als 5 Jahre, 30% zwischen 5 und 10 Jahre und 10% älter als 10 Jahre alt sind. Diese „Goldene Regel“ von COCIR verfehlt die EU 27 laut Daten des Verbands von 2023 bereits deutlich (49%/20%/31%), in Deutschland liegen die Werte allerdings nochmals deutlich schlechter (26%/18%/56%) als im europäischen Mittel. Der Investitionsstau Deutschlands zeigt sich auch in der Dichte, also der Anzahl von Geräten pro Million Einwohner. Diese liegt in der EU bei 2,9 und in Deutschland nur bei 2,5.
Folge 113: Gesundheitsversorgung mit Krankenhausversorgungsverbesserungsgesetz zukunftsfähig aufstellen

Für ein zukunftsfähiges Gesundheitswesen sind stabile Rahmenbedingungen und Planungssicherheit für alle Akteure unerlässlich, um den vielfältigen Herausforderungen gerecht zu werden. Der ZVEI unterstützt daher den Vorstoß des Bundesministeriums für Gesundheit (BMG) mit dem Krankenhausversorgungsverbesserungsgesetz (KHVVG). Dieses Gesetz zielt darauf ab, die Qualität der Krankenhausversorgung zu verbessern und die Vergütungsstrukturen anzupassen – Schritte, die in der aktuellen Lage als notwendig erachtet werden.
Interoperabilität, Vernetzung und ein verlässlicher Datenschutz – diesen Punkten muss das KHVVG gerecht werden. Nur so kann moderne medizintechnische Ausstattung zu einer effektiven Gesundheitsversorgung und zur Transformation der Versorgungsstrukturen beitragen. Weiterhin ist eine nahtlose digitale Vernetzung nach internationalen Standards entscheidend, um die ambulante und stationäre Versorgung effizient zu verknüpfen und die Patientenversorgung zu optimieren.
Besondere Bedeutung kommt der Einbindung der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) und der Spitzenverbände der industriellen Gesundheitswirtschaft in Deutschland in die Fortschreibung des KHVVG zu. Sie müssen die Möglichkeit haben, aktiv an der Weiterentwicklung und Anpassung der Leistungsgruppen mitzuwirken. Nur so können die aktuellen Erkenntnisse und Technologien der Medizin angemessen berücksichtigt werden, um die Qualität und Effizienz der Versorgung kontinuierlich zu verbessern.
Folge 112: Deutschlands Rolle im European Health Data Space (EHDS) schon jetzt vorbereiten

Das Europäische Parlament wird voraussichtlich noch im April 2024 dem Vorschlag für eine Verordnung über den europäischen Raum für Gesundheitsdaten zustimmen. Mit der Verordnung soll ein europäischer Raum für Gesundheitsdaten (European Health Data Space – EHDS) mit Vorschriften, gemeinsamen Standards und Verfahren, Infrastrukturen und einem Governance-Rahmen für die Primär- und Sekundärnutzung elektronischer Gesundheitsdaten geschaffen werden. Elektronische Gesundheitsdaten sollen EU-weit grenzüberschreitend sowohl in der medizinischen Versorgung aber auch für die Forschung (Sekundärnutzung) verwendet werden können. Dabei muss sichergestellt werden, dass die technischen Anforderungen der EHDS-Verordnung keine Widersprüche oder Doppelregulierung zur EU-Verordnung über Medizinprodukte (MDR) erzeugen.
Aus dem EHDS ergeben sich für Deutschland Verpflichtungen Gesundheitsdaten aus Deutschland zur Verfügung zu stellen und Strukturen aufzubauen, die es erlauben Gesundheitsdaten aus Deutschland innerhalb des EHDS zu teilen. Elektronische Gesundheitsdaten aus Deutschland müssen für die primäre und sekundäre Nutzung im EHDS zur Verfügung stehen. Um die datenbasierte Forschung in der Gesundheitswirtschaft am Standort Deutschland zu stärken, sollte das Gesundheitsdatennutzungsgesetz (GDNG), das in Deutschland gerade in Kraft getreten ist, so bald wie möglich an die Regelungen der EHDS-Verordnung angepasst werden. Die Nutzung von Gesundheitsdaten sollte in Deutschland so schnell wie möglich im selben Umfang möglich werden, wie es im EHDS in Zukunft der Fall sein wird.
Folge 111: AI Act und KI in der Gesundheitswirtschaft - offene Fragen schnell klären!

Die Anwendung „Künstlicher Intelligenz“ (KI) in der Gesundheitswirtschaft nimmt in dieser Woche auf der Messe DMEA in Berlin breiten Raum ein. Experten sehen großes Potenzial für die medizinische Forschung, aber auch dafür, das Personal in Gesundheitseinrichtungen zu entlasten. KI kann damit Teil der Antwort auf den Fachkräftemangel in der medizinischen Versorgung sein.
Mit dem AI Act, der voraussichtlich in den nächsten Wochen verabschiedet wird und noch in diesem Jahr in Kraft treten wird, regelt die Europäische Union erstmals und umfassend die Anforderungen an alle Anwendungen von KI. Software, die eine KI nutzt und eine medizinische Zweckbestimmung hat, wird als Medizinprodukt betrachtet. Diese Medizinprodukte unterliegen bereits den Anforderungen der Medizinprodukte-Verordnung der EU (MDR). Das MedTech Telegram 110 hat thematisiert, dass die Abgrenzung zwischen MDR und AI Act schnell geklärt werden muss, damit Probleme für die medizinische Versorgung verhindert werden.
Offene Fragen gibt es aber auch bei Anwendungen, die KI nutzen, aber keine Medizinprodukte sind, obwohl sie in der Gesundheitswirtschaft eingesetzt werden. KI kann das Personal in Gesundheitseinrichtungen bei vielen Abläufen in der medizinischen Versorgung unterstützen und von zeitaufwändigen Routineaufgaben entlasten. Auch für diese Anwendungen muss schnell geklärt werden, welche Anforderungen der AI Act stellt, damit sie in der Gesundheitswirtschaft genutzt werden können.
Fachkräfte von Routinearbeiten und Dokumentationsaufwand zu entlasten, erhöht die Zeit, die für Betreuung der Patientinnen und Patienten zur Verfügung steht. Das deutsche Gesundheitssystem kann nicht auf die Chance verzichten mit KI gegen den Fachkräftemangel in der medizinischen Versorgung vorzugehen.
Folge 110: AI Act und MDR - schnelle Klärung notwendig

Das Europäische Parlament hat am 13.03.2024 den „AI Act“ verabschiedet, mit dem die Europäische Union die Anwendung von künstlicher Intelligenz umfassend regelt. Die Mitgliedstaaten der EU werden die Verordnung wahrscheinlich Ende April verabschieden. Danach tritt die Verordnung in Kraft.
Der „AI Act“ deckt grundsätzlich alle Bereiche ab, die künstliche Intelligenz nutzen wollen. Dazu gehört auch der Bereich Gesundheit und die Branche Medizintechnik. Der ZVEI hat in den Beratungen zum „AI Act“ immer wieder darauf hingewiesen, dass die Gefahr von Doppelregulierung und Widersprüchen zur EU-Verordnung für Medizinprodukte (MDR) droht.
Die MDR stellt bereits hohe Anforderungen an Medizinprodukte, die Software beinhalten und künstliche Intelligenz nutzen. Der „AI Act“ muss in Zukunft für einen großen Teil der Medizinprodukte zusätzlich zur MDR beachtet werden. Die Anforderungen des „AI Act“ unterscheiden sich aber wegen der Gültigkeit für alle Anwendungsbereiche von denen in der MDR. Das kann dazu führen, dass Hersteller von Medizinprodukten nicht sicher beurteilen können, welche Anforderungen einzuhalten sind. Das kann dazu führen, dass innovative Medizinprodukte in de EU nicht auf den Markt gebracht werden können.
Es ist deshalb gut, dass die Europäische Kommission zum Ende der Beratungen über den „AI Act“ eine eigene Arbeitsgruppe angekündigt hat. Diese Arbeitsgruppe soll offene Fragen zur Anwendung des „AI Act“ auf Produkte klären, die anderen EU-Regulierungen, wie zum Beispiel der MDR, unterliegen. Die meisten Medizinprodukte, die vom AI Act betroffen sind, werden in die Kategorie der „Hochrisiko-Produkte“ eingeordnet. Für die MDR müssen diese offenen Fragen deshalb so schnell wie möglich geklärt werden, damit die Versorgung der EU-Mitgliedstaaten mit Medizinprodukten nicht in Gefahr gerät.
Die Bundesregierung will diesen Prozess in Deutschland bereits jetzt durch eine sehr frühe Diskussion mit den betroffenen Branchen unterstützen. Das ist ein wichtiger Schritt, um die komplexe Diskussion auf europäischer Ebene zu beschleunigen.
Folge 109: EU auch 2023 wichtigster Exportmarkt der deutschen elektromedizinischen Industrie

Der europäische Markt hat sich für die Exporte deutscher elektromedizinischer Produkte im letzten Jahr als großer Stabilisator bewährt. Von den insgesamt 16,6 Mrd. Euro (+4,0%) weltweiter Ausfuhr entfielen 5,5 Mrd. Euro auf die Staaten der EU-27, gefolgt von 3,9 Mrd. Euro Anteil für die USA und 1,5 Mrd. für China. Einem Wachstum von 13,8% in Europa standen dabei Rückgänge von 1,7 % in den USA sowie 4,5% in China gegenüber.
Auch im Fünfjahrestrend bestätigt sich die Stärke und Bedeutung des Heimatmarkts Europa für Erzeugnisse der elektromedizinischen Industrie in Deutschland. Das globale Wachstum dieser Exporte lag im Zeitraum 2018-2023 bei 23,5%, was innerhalb der europäischen Staatengemeinschaft mit 33,2% - in den Ländern der Euro-Zone sogar mit 36,3% - deutlich übertroffen wurde. Knapp unterdurchschnittlich wuchs die Ausfuhr in die USA mit 22,6%, während China nur um 8,8% zulegen konnte.
Vor diesem Hintergrund erscheint es umso wichtiger, dass die EU-Regulierungen im Bereich der Medizinprodukte keine zusätzlichen Hürden für den Zugang innovativer Lösungen in die Patientenversorgung in Deutschland und Europa bewirken. Neben der Medizinprodukteverordnung (MDR) gilt dies in besonderer Weise auch für den AI Act der EU, die sich ausweitende Umweltgesetzgebung und die zunehmenden Anforderungen an Cybersicherheit.
Folge 108: Erneute Bewertung von Bestandsprodukten nach MDR-Regeln noch immer nicht abgeschlossen

Die Anwendung der EU-Verordnung für Medizinprodukte (MDR) kommt auch fast sieben Jahre nach Verabschiedung der Verordnung im Mai 2017 nur langsam voran. Die Gefahr, dass bewährte Medizinprodukte aus formalen Gründen nicht mehr vermarktet werden können, besteht weiter.
Die MDR verlangt, dass alle Bestandsprodukte, die bereits eine CE-Kennzeichnung nach der früher geltenden Richtlinie für Medizinprodukte (MDD) haben, nach den Regeln der MDR ein neues Verfahren zur Konformitätsbewertung durchlaufen. Dafür müssen verschiedene Zertifikate von den Benannten Stellen neu erteilt werden. Im Auftrag der Europäischen Kommission wird regelmäßig bewertet, welche Fortschritte die Benannten Stellen hierbei machen.
Aktuelle Zahlen der Europäischen Kommission zur Situation im Oktober 2023 zeigen, dass die Zahl der neu ausgestellten Zertifikate deutlich gestiegen ist. Allerdings waren im Oktober 2023 von 17846 gestellten Anträgen erst 5.599 Zertifikate neu ausgestellt. Fast 70 Prozent der Anträge für Bestandsprodukte müssen also noch bearbeitet werden. Die aktuelle Analyse zeigt außerdem, dass im Oktober 2023 weniger als 25 Prozent der Hersteller von Medizintechnik die neue Konformitätsbewertung ihrer Bestandsprodukte bereits vollständig abgeschlossen hatten.
Die Benannten Stellen sind also weiterhin überlastet. Der Rückstau bei den Bestandsprodukten verzögert dabei auch immer mehr die Einführung neuer Medizinprodukte auf dem europäischen Markt. Im internationalen Wettbewerb belastet das Deutschland und Europa als Standort für die dynamische Branche Medizintechnik immer mehr.
Die Bundesregierung muss sich deshalb auf europäischer Ebene dafür einsetzen, dass pragmatische Lösungen gefunden werden, damit Bestandsprodukte und Nischenprodukte der Medizintechnik für die medizinische Versorgung in der EU ohne Unterbrechung zur Verfügung stehen können.
Folge 107: Immer noch zu wenig notifizierte Benannte Stellen in der EU für die MDR

Am 21. Dezember 2023 gab es nach Angaben der Europäischen Kommission insgesamt 43 Benannte Stellen für die MDR in der EU. Fast sechs Jahre nach Verabschiedung der EU-Verordnung für Medizinprodukte (MDR) gibt es immer noch weniger Benannte Stellen als für die früher gültige Medizinprodukte-Richtlinie (MDD). Aktuell sind nach Angaben der Europäischen Kommission 43 Benannte Stellen in der EU für die MDR notifiziert. Für die MDD waren insgesamt 58 Benannte Stellen notifiziert.
Die notwendige erneute Konformitätsbewertung aller Medizinprodukte wird dadurch weiter verzögert. Immer noch besteht die Gefahr, dass bewährte Medizinprodukte vom Markt genommen werden müssen, weil die neue Konformitätsbewertung nicht rechtzeitig abgeschlossen werden kann.
Ende Dezember waren noch Anträge von 16 weiteren Benannten Stellen in Bearbeitung. Diese Anträge müssen so schnell wie möglich bearbeitet und die Stellen offiziell notifiziert werden, damit Engpässe bei der Versorgung mit Medizinprodukten vermieden werden können.
Auf der Webseite der Europäischen Kommission ist die aktuelle Übersicht verfügbar.
Folge 106: GDNG zügig umsetzen und Strukturen ausreichend finanzieren

Nachdem der Bundestag das Gesundheitsdatennutzungsgesetz (GDNG) im Dezember 2023 verabschiedet hat, müssen die Inhalte des Gesetzes jetzt zügig umgesetzt werden. Das BMG muss die im Gesetz vorgesehenen Verordnungen zur Umsetzung deshalb schnell mit Wissenschaft und Wirtschaft abstimmen. Die Regelungen des GDNG müssen mit den anderen Teilen der Digitalisierungsstrategie Gesundheit und Pflege Hand in Hand gehen.
Die neuen Strukturen und die zusätzlichen Aufgaben bei vorhandenen Stellen müssen außerdem ausreichend finanziert werden, damit Deutschland als Standort für Gesundheitsforschung im internationalen Wettbewerb gestärkt wird. Das Forschungsdatenzentrum (FDZ) soll in Zukunft Gesundheitsdaten aus Deutschland für die Forschung und Entwicklung zur Verfügung stellen. Dadurch soll die medizinische Versorgung in Deutschland weiter verbessert werden. In der Gesundheitswirtschaft wird ein großer Teil der Forschung und Entwicklung durch die Industrie geleistet. Es ist positiv, dass die industrielle Gesundheitswirtschaft in Zukunft direkt Anträge zur Datennutzung bei FDZ stellen kann.
Im internationalen Wettbewerb der Standorte für Forschung und Entwicklung in der Gesundheitswirtschaft muss Deutschland aufholen. Damit dies gelingt, müssen die Strukturen, die durch das GDNG geschaffen werden, ausreichend finanziert werden. Zum Beispiel muss das FDZ in der Lage sein, viele Projekte zur Nutzung von Gesundheitsdaten aus vielen verschiedenen Quellen schnell zu unterstützen. Deshalb müssen dem FDZ ausreichend Mittel zur Verfügung stehen, damit Forschung und Entwicklung für die Gesundheitswirtschaft in Deutschland nachhaltig gestärkt werden.
In Medtech Telegram 105 hat der ZVEI auf die starken wirtschaftlichen Effekte der Digitalisierung der deutschen Gesundheitswirtschaft hingewiesen.
MedTech-Telegram 2023
Folge 105: Starke wirtschaftliche Effekte durch Digitalisierung des Gesundheitssystems
Das Digitalisierungs-Gesetz (DigiG) und das Gesundheitsdatennutzungsgesetz (GDNG) werden in dieser Woche abschließend im Deutschen Bundestag beraten. Wenn beide Gesetze wie vorgeschlagen verabschiedet werden, wird die Digitalisierung des deutschen Gesundheitssystems wichtige Fortschritte machen. Das ist nicht nur gut für die Qualität der medizinischen Versorgung in Deutschland, sondern stärkt auch die Forschung und Entwicklung an innovativen medizinischen Methoden, modernen Medizinprodukten und neuen Arzneimitteln.
Eine konsequente Digitalisierung des deutschen Gesundheitssystems kann die Bruttowertschöpfung der industriellen Gesundheitswirtschaft in Deutschland bis 2030 gegenüber dem Status quo um acht Milliarden Euro erhöhen. Zu diesem Ergebnis kommt die aktuelle Studie des BDI zu den Wachstumspotenzialen der industriellen Gesundheitswirtschaft in Deutschland. Im besten Fall einer weitreichenden Digitalisierung der Abläufe und Prozesse im deutschen Gesundheitssystem entspricht das einem Zuwachs von 39 Prozent gegenüber dem Jahr 2022.
Auch wegen dieser starken positiven Effekte für die deutsche Wirtschaft unterstützt der ZVEI die Verabschiedung von DigiG und GDNG.
Folge 104: Deutsche wollen ePA auch selbst über eine App nutzen
Die „ePA für alle“, die mit dem Digitalisierungs-Gesetz (DigiG) eingeführt werden soll, wird von drei Viertel der Deutschen grundsätzlich positiv gesehen. Das Interesse geht aber über den Einsatz beim Arztbesuch hinaus. Fast ebenso viele Menschen würden auf alle Fälle oder sehr wahrscheinlich eine App ihrer Krankenkasse nutzen, um selbst die Inhalte der ePA anzusehen. Das ist das Ergebnis einer aktuellen Umfrage der GfK zur ePA, die im Auftrag des ZVEI durchgeführt wurde. Nur 11 Prozent der Befragten gaben an, dass sie eine solche App auf keinen Fall oder sehr wahrscheinlich nicht nutzen würden.
Die Ergebnisse zeigen, dass die Deutschen die ePA auch aktiv nutzen wollen. Das kommt auch darin zum Ausdruck, dass 75 Prozent der Befragten erwarten, dass Ärztinnen und Ärzte nach einem Termin zur Diagnose oder Behandlung neue Informationen ohne Aufforderung in die ePA eintragen. Zwar finden es 77 Prozent der Befragten wichtig oder sehr wichtig, dass Patientinnen und Patienten in der ePA Inhalte auch verbergen können. Aber 68 Prozent der Befragten sind zugleich bereit, dass Daten aus der ePA für die Forschung und Entwicklung an neuen medizinischen Methoden und innovativen Medizinprodukten und Arzneimitteln genutzt werden. Wichtig ist darum zusätzlich eine gezielte Aufklärung der Patientinnen und Patienten darüber, welche persönlichen positiven Vorteile sich aus der Nutzung der gesamten ePA ergeben.
Folge 103: Gesundheitsdatennutzungsgesetz: Die Deutschen sind bereit Forschung zu unterstützen
Mit dem Gesundheitsdatennutzungsgesetz (GDNG) soll die Nutzung von Gesundheitsdaten in Deutschland verbessert werden. Daten aus der elektronischen Patientenakte (ePA) sollen über das Forschungsdatenzentrum (FDZ) für die Forschung und Entwicklung zur Verfügung stehen. Wer seine Daten nicht für die Forschung zur Verfügung stellen will, kann sich per „Opt Out“ dagegen entscheiden. Eine aktuelle repräsentative Umfrage der GfK im Auftrag des ZVEI zeigt, dass eine große Mehrheit der Deutschen diese Datennutzung positiv sieht. 68 Prozent der Befragten stehen einer Verwendung ihrer Daten aus der ePA für die Forschung und Entwicklung positiv gegenüber. Die Befragten gehen dabei davon aus, dass diese Daten im FDZ keinen Personenbezug haben und der Verwendungszweck der Daten geprüft wurde.
Die Bürgerinnen und Bürger wollen aber souverän mit ihren Daten umgehen können, wenn sie persönlich betroffen sind. 77 Prozent der Befragten finden es sehr wichtig oder wichtig die Möglichkeit zu haben Daten für bestimmte Benutzer unsichtbar zu machen. Die Befragten nehmen dabei in Kauf, dass dadurch vielleicht relevante Informationen nicht zur Verfügung stehen. Die Bürgerinnen und Bürger unterscheiden also deutlich zwischen der Nutzung von Gesundheitsdaten ohne Personenbezug für Forschung und Entwicklung und der Nutzung ihrer eigenen Gesundheitsdaten bei der eigenen medizinischen Versorgung. Der Entwurf des GDNG berücksichtigt diese Sichtweise.
Das GDNG kann die Nutzung von Gesundheitsdaten für die Forschung und Entwicklung in Deutschland verbessern. Das stärkt Deutschland als Standort der Gesundheitswirtschaft und kann die medizinische Versorgung verbessern.
Folge 102: Die Deutschen wollen die elektronische Patientenakte
Mit dem Digital-Gesetz soll die gesetzliche Grundlage dafür gelegt werden, dass alle gesetzlich versicherten Personen eine elektronische Patientenakte (ePA) erhalten. Wer keine ePA nutzen möchte, kann sich per „Opt Out“ dagegen entscheiden. Eine aktuelle repräsentative Umfrage der GfK im Auftrag des ZVEI zeigt, dass die überwiegende Mehrheit der Deutschen die flächendeckende Einführung der ePA unterstützt. 71 Prozent der Befragten sehen die ePA für sich positiv. Nur 17 Prozent sehen keine Vorteile in einer elektronischen Akte. 12 Prozent der Befragten haben sich noch keine Meinung gebildet.
Die positive Erwartung der Bürgerinnen und Bürger an die ePA drückt sich auch darin aus, dass 76 Prozent der Befragten erwarten, dass Ärztinnen und Ärzte zu Beginn einer Behandlung die ePA einsehen wollen, um alle Informationen zur Verfügung zu haben. Dementsprechend erwarten auch 75 Prozent der Befragten, dass Ärztinnen und Ärzte neue Informationen ohne Aufforderung durch Patientinnen und Patienten in der ePA speichern, damit die Informationen in der ePA aktuell und vollständig sind.
Diese Erwartungen der Deutschen sollten im Gesetzgebungsverfahren zum Digital-Gesetz (DigiG) berücksichtigt werden, damit die ePA die Gesundheitsversorgung der Bürgerinnen und Bürger unterstützt.
Folge 101: Schwierige MDR-Anwendung bedroht auch Export von Medizintechnik
Die Probleme und Verzögerungen bei der Anwendung der „Medical Devices Regulation“ (MDR) der Europäischen Union sind nicht nur für die sichere Versorgung der Gesundheitssysteme in der EU eine Herausforderung. Auch beim Export von Medizintechnik aus Deutschland kann es Auswirkungen geben. Das ist besonders kritisch, da die deutsche medizintechnische Industrie fast 70 Prozent ihres Umsatzes im Export erzielt.
Die MDR schreibt vor, dass auch Medizinprodukte mit einer CE-Kennzeichnung nach der bisher geltenden EU-Richtlinie für Medizinprodukte (MDD) eine neue Konformitätsbewertung nach der MDR durchlaufen. Durch die geltenden Fristen für Übergangsregeln für diese sogenannten Bestandsprodukte und die langsame Notifizierung der Benannten Stellen für die MDR gibt es hier enorme Verzögerungen. Um zu verhindern, dass bewährte Medizinprodukte wegen formaler Probleme in der EU vom Markt genommen werden müssen, hat die Europäischen Union im März 2023 die Verordnung (EU) 2023/607 erlassen. Mit dieser Verordnung werden die Übergangsfristen für Bestandsprodukte unter bestimmten Bedingungen noch einmal verlängert.
Diese im Frühjahr getroffenen Maßnahmen müssen auch im Ausland erläutert werden. Zahlreiche Länder außerhalb der EU überprüfen beim Import von Medizinprodukten aus der EU, ob diese Medizinprodukte in den Ländern der Europäischen Union auf den Markt gebracht werden dürfen. Es muss deshalb sichergestellt werden, dass die Importbehörden in diesen Ländern über die neuen Regelungen informiert sind und den Import der Produkte nicht unnötig behindern.
Die Europäische Kommission hat inzwischen einen “Fact Sheet” zur Information für Drittstaaten veröffentlicht. Im Rahmen der Konferenz des International Medical Device Regulators Forum (IMDRF) wurde am 26. September 2023 zusätzlich eine Informationsveranstaltung für internationale Behördenvertreter organisiert.
Zu diesem Punkt müssen BMWK, BMG und Auswärtiges Amt gemeinsam aktiv werden, um die deutsche medizintechnische Industrie in Auslandsmärkten zu unterstützen.
Folge 100: Die Gesundheitswirtschaft schafft und sichert weiterhin Arbeitsplätze

2016 veröffentlichte der ZVEI das erste MedTech-Telegram . Sieben Jahre mit regelmässigen Informationen über aktuelle Themen aus diesem dynamischen und innovativen Teil der deutschen Wirtschaft liegen hinter uns. Die Folge 100 ist die perfekte Gelegenheit für einen Rückblick und das Fazit, dass die Gesundheitswirtschaft die Erwartungen von damals erfüllt.
Seit 2016 ist die deutsche Gesundheitswirtschaft stetig gewachsen. Die Beschäftigung ist von 7 Millionen in 2016 auf 8,1 Millionen in 2022 gestiegen. Dabei ist der Anteil der Beschäftigten der deutschen Gesundheitswirtschaft an der Gesamtbeschäftigung um 1,6 Prozentpunkte auf 17,7 Prozent gestiegen. Auch die Exporte legten deutlich zu und die Branche hat ihren Anteil an den deutschen Gesamtexporten um 1,7 Prozentpunkte ausgebaut. 2022 exportierte die deutsche Gesundheitswirtschaft 70,1 Milliarden Euro mehr als noch 2016. Auch die Gesamtbruttowertschöpfung der deutschen Gesundheitswirtschaft zog kräftig von 336,4 Milliarden auf 439,6 Milliarden Euro an.
Die Branche entwickelt sich seit 2016 ausnehmend gut. Damit das auch in Zukunft so bleibt, müssen die Rahmenbedingungen stimmen. Es ist daher richtig, dass sich das BMWK durch den “Round Table Gesundheitswirtschaft” seit dem letzten Jahr mit diesem dynamischen Wirtschaftszweig befasst und die Rahmenbedingungen für die Gesundheitswirtschaft in Deutschland verbessern will.
Folge 99: Sechs Jahre nach Verabschiedung der MDR noch immer zu wenig Benannte Stellen

Die Europäische Kommission hat am 24. August eine aktuelle Übersicht zum Stand der Notifizierung von Benannten Stellen für die MDR veröffentlicht. Auch sechs Jahre nach Verabschiedung der MDR sind erst knapp zwei Drittel der Anträge von Prüfstellen mit einer Listung als Benannte Stelle abgeschlossen worden. Laut der Übersicht der Europäischen Kommission haben bisher 39 von insgesamt 62 Anträgen zu einer Listung als Benannte Stelle in der Datenbank NANDO geführt. Weitere 23 Anträge befinden sich in verschiedenen Stufen der Bearbeitung. Allerdings hat noch keiner dieser Anträge die zweite Hälfte des Verfahrens erreicht.
Hersteller von Medizinprodukten können deshalb die vorgeschriebene erneute Konformitätsbewertung aller Medizinprodukte weiterhin nicht verlässlich kalkulieren. Die Europäische Kommission und die Mitgliedstaaten haben deshalb im März 2023 die Übergangsfristen für Bestandsprodukte in der MDR nochmals verlängert. Dieser Schritt wurde notwendig, um Engpässe bei der Versorgung mit Medizinprodukten in den nächsten Jahren möglichst zu vermeiden.
Die Versorgung mit Medizinprodukten in der EU kann erst dauerhaft sichergestellt werden, wenn alle 62 Benannten Stellen bei NANDO gelistet sind. Erst dann hat die Zahl der Benannten Stellen für die MDR wieder das Niveau der Benannten Stellen für die früher geltende MDD erreicht.
Der Engpass bei den Benannten Stellen wird die Umsetzung der MDR also weiter behindern. Das Thema erfordert deshalb weiter die Aufmerksamkeit der Politik in Deutschland und Europa.
Folge 98: Gesundheitsversorgung modern und bedarfsgerecht organisieren

Die Gesundheitsversorgung in Deutschland muss insgesamt modern und bedarfsgerecht organisiert werden. Eine zentrale Herausforderung für das Gesundheitssystem ist dabei die demografische Entwicklung. Sie führt zu steigenden Anforderungen an die medizinische Versorgung und weniger medizinischem und pflegerischem Personal in den Krankenhäusern. Um dieser Entwicklung erfolgreich zu begegnen, muss die Gesundheitsversorgung in Deutschland umfassend modernisiert und digitalisiert werden.
In den nächsten zehn Jahren wird in Deutschland der Anteil der Menschen, die über 67 Jahre alt sind, nach Berechnungen des Statistischen Bundesamts von 20 Prozent der Bevölkerung auf 25 Prozent der Bevölkerung steigen. Im Jahr 2033 gehören dann 20,4 Millionen Menschen zu dieser Altersgruppe. Das sind 3,7 Millionen Menschen mehr als im Jahr 2023. Als Folge wird auch die Zahl der Krankenhausbehandlungen für Herz-Kreislauf-Erkrankungen, Krebs und andere Krankheiten steigen. Dieser schon heute absehbare Anstieg muss bei der Planung einer modernen und bedarfsgerechten medizinischen Versorgung berücksichtigt werden. Dazu gehört auch die medizintechnische Infrastruktur in deutschen Krankenhäusern zu modernisieren und zu digitalisieren, um auf dem Stand von Medizin und Technik effizient behandeln zu können.
Folge 97: Krankenhausreform als Chance zur Modernisierung nutzen

Die geplante Krankenhausreform kann der Startpunkt sein, um die Gesundheitsversorgung in Deutschland insgesamt nachhaltig und zukunftsfähig zu organisieren. Eine zentrale Herausforderung für das Gesundheitssystem ist dabei die demografische Entwicklung. Sie führt zu steigenden Anforderungen an die medizinische Versorgung und weniger medizinischem Personal in den Krankenhäusern. Um dieser Entwicklung erfolgreich zu begegnen, ist eine moderne medizintechnische Infrastruktur notwendig. Die vorhandene medizintechnische Infrastruktur in deutschen Krankenhäusern ist aber an vielen Stellen veraltet und nicht ausreichend digitalisiert. Das liegt daran, dass die Finanzierung der Investitionskosten der Krankenhäuser in Deutschland seit vielen Jahren unzureichend ist.
So sind etwa über die Hälfte der Computertomographen in Deutschland laut einer Cocir-Studie älter als sechs Jahre, 20 Prozent sogar älter als zehn Jahre. Ähnlich sieht es bei Röntgengeräten aus: Hier sind zwei Drittel älter als sechs Jahre, 30 Prozent älter als zehn Jahre. Damit moderne digitale Prozesse in der Gesundheitsversorgung erfolgreich und flächendeckend angewendet werden können, müssen medizintechnische Geräte diese Prozesse auch unterstützen können. Die Geräte allerdings, die älter als sechs Jahre sind, können nicht optimal in diese integriert werden. Dadurch werden moderne datenbasierte Behandlungsabläufe unterbrochen oder verzögert – und damit auch die digitale Transformation der Gesundheitsversorgung.
Die medizintechnische Infrastruktur in deutschen Krankenhäusern muss deshalb dringend modernisiert und digitalisiert werden, um auf dem Stand von Medizin und Technik effizient behandeln zu können. Sie ist Voraussetzung dafür die von der „Regierungskommission für eine moderne und bedarfsgerechte Krankenhausversorgung“ vorgeschlagenen Ziele zu erreichen.
Folge 96: Dynamisch und zukunftsfähig - Gesundheitswirtschaft in Deutschland fördern

Die aktuellen Zahlen zur „Gesundheitswirtschaftlichen Gesamtrechnung“ des BMWK belegen die dynamische Entwicklung der Gesundheitswirtschaft in Deutschland. Die Gesundheitswirtschaft macht 12,7 Prozent der Bruttowertschöpfung Deutschlands aus. Das waren im Jahr 2022 439,6 Mrd. Euro. Inzwischen arbeiten in Deutschland über 8 Mio. Menschen in der Gesundheitswirtschaft.
Auffällig ist dabei, dass die Bruttowertschöpfung der deutschen Gesundheitswirtschaft in den letzten zehn Jahren stabil um durchschnittlich 4,6 Prozent pro Jahr gewachsen ist. Das jährliche Wachstum der Bruttowertschöpfung der deutschen Gesamtwirtschaft betrug in diesem Zeitraum im Vergleich durchschnittlich 3,5 Prozent. Die Gesundheitswirtschaft trägt damit überdurchschnittlich zum Wachstum der deutschen Wirtschaft bei.
Die Gesundheitswirtschaft sollte in Deutschland deshalb als dynamische und zukunftsfähige Branche gefördert werden. Es ist richtig, dass das BMWK mit dem „Round Table Gesundheitswirtschaft“ eine wirtschaftspolitische Diskussion über die Gesundheitswirtschaft in Deutschland begonnen hat.
Folge 95: Deutsche Elektromedizin wächst weiter

Die deutsche Elektromedizin ist weiter auf Wachstumskurs und ihre Produkte werden global stark nachgefragt. Produktion und Exporte zeigen positiv nach oben. Das besagen die aktuellen Zahlen des ZVEI für Produkte der elektromedizinischen Technik für das Gesamtjahr 2022. Die Produktion stieg um 3,9 Prozent auf 9,5 Milliarden Euro. Elektromedizin „Made in Germany“ ist auch weiterhin ein Exportschlager. Insgesamt sind die Exporte in 2022 von 16,6 Milliarden Euro auf 17,2 Mrd. Euro gestiegen. Das entspricht einem Wachstum von 3,5 Prozent. Die Importe sind leicht um 2,8 Prozent auf 9,5 Milliarden Euro gestiegen. Der Exportüberschuss Deutschlands in diesem Bereich ist also gestiegen. Wachstumstreiber sind der global stattfindende demografische Wandel, die digitale Transformation in der medizinischen Versorgung und die immer genauer am Bedarf der Anwender ausgerichteten Angebote der Industrie.
Das bestätigt das Bild, das sich in der aktuellen Gesundheitswirtschaftlichen Gesamtrechnung des BMKW darstellt. 12,7 Prozent der gesamten Bruttowertschöpfung in Deutschland entfällt auf die Gesundheitswirtschaft, was insgesamt 439,6 Milliarden Euro entspricht. Die industriellen Gesundheitswirtschaft in Deutschland trägt hier fast ein Viertel dazu bei (23,4 Prozent). Mehr dazu in MedTech-Telegram Folge 94.
Folge 94: Bedeutung der industriellen Gesundheitswirtschaft weiter gestiegen

Das BMWK hat aktuelle Daten zur deutschen Gesundheitswirtschaft veröffentlicht. Nach der Gesundheitswirtschaftlichen Gesamtrechnung des BMWK ist gesamte Gesundheitswirtschaft in den letzten zehn Jahren beständig gewachsen. Von den insgesamt 45,58 Millionen erwerbstätigen Menschen in Deutschland arbeiten fast 8,1 Millionen in der Gesundheitswirtschaft. Das ist jeder sechste erwerbstätige Mensch in Deutschland.
Im Jahr 2022 hat die Gesundheitswirtschaft insgesamt eine Wertschöpfung von 439,6 Milliarden Euro erwirtschaftet. Das entspricht 12,7 Prozent der gesamten Bruttowertschöpfung in Deutschland. Die industriellen Gesundheitswirtschaft in Deutschland trägt fast ein Viertel dazu bei (23,4 Prozent).
Die industrielle Gesundheitswirtschaft ist in den letzten zehn Jahren kontinuierlich gewachsen. Das durchschnittliche Wachstum von 5,1 Prozent pro Jahr seit 2013 ist sogar höher als das durchschnittliche Wachstum der Gesundheitswirtschaft im selben Zeitraum (4,6 Prozent pro Jahr).
Mit 103 Milliarden Euro Bruttowertschöpfung hat die industrielle Gesundheitswirtschaft im Jahr 2022 ein neues Allzeithoch erreicht.
Folge 93: Standort Deutschland fördern – Ressourcen für FDZ großzügig planen

Das Forschungsdatenzentrum (FDZ) soll nach den Vorstellungen von Bundesgesundheitsminister Lauterbach in Zukunft Gesundheitsdaten aus Deutschland für die Forschung und Entwicklung zur Verfügung stellen. Dadurch soll auch die medizinische Versorgung in Deutschland weiter verbessert werden. In der Gesundheitswirtschaft wird ein großer Teil der Forschung und Entwicklung durch die Industrie geleistet. Es ist positiv, dass die industrielle Gesundheitswirtschaft direkt Anträge zur Datennutzung bei FDZ stellen können soll. Dadurch wird der Standort Deutschland im internationalen Wettbewerb gestärkt.
Damit dies gelingt, muss das FDZ in der Lage sein, viele Projekte zur Nutzung von Gesundheitsdaten aus vielen verschiedenen Quellen schnell zu unterstützen. Die Nutzung der Daten des FDZ soll auf Antrag und unter Berücksichtigung des Zwecks der beabsichtigten Forschungs- und Entwicklungsaktivitäten möglich sein. Das FDZ muss deshalb in der Lage sein, Anträge schnell zu bewerten und die Datennutzug freizugeben. Danach muss der Zugang zu den Daten hergestellt und die Nutzung im Rahmen des Projektes ermöglicht werden. Zusätzlich sollte das FDZ den interessierten Kreisen auch Information und Beratung anbieten, welche Daten zur Verfügung stehen und wie diese Daten für Forschung und Entwicklung genutzt werden können.
Dem FDZ müssen ausreichend Mittel zur Verfügung stehen, um diese Aufgaben dauerhaft zu erfüllen, wenn Forschung und Entwicklung für die Gesundheitswirtschaft in Deutschland nachhaltig gestärkt werden sollen. Im internationalen Wettbewerb der Standorte für Forschung und Entwicklung in der Gesundheitswirtschaft muss Deutschland aufholen. Dieses Ziel muss bei der Debatte über das geplante Gesundheitsdatennutzugsgesetz (DGNG) berücksichtigt werden.
Folge 92: Standort fördern durch unkomplizierte Nutzung von Gesundheitsdaten

Bundesgesundheitsminister Lauterbach hat angekündigt, dass durch die bessere Nutzung von Gesundheitsdaten insbesondere auch die Forschung und Entwicklung in Deutschland unterstützt werden soll. Dazu sollen weitere Gesundheitsdaten im Forschungsdatenzentrum (FDZ) zusammengeführt werden. Es ist positiv, dass auch die Forschung der industriellen Gesundheitswirtschaft in Deutschland die Möglichkeit erhalten soll, Daten im FDZ direkt zu nutzen.
Deutschland kann dadurch im internationalen Wettbewerb der Standorte für Forschung und Entwicklung in der Gesundheitswirtschaft aufholen. Davon wird auch die medizintechnische Industrie am Standort profitieren. Deutschland kann so seine international führende Position beim Export von Medizintechnik festigen. Damit dies gelingt muss es für alle interessierten Kreise unkompliziert sein die Daten im FDZ zu nutzen. Dieses Ziel muss bei der Debatte über das geplante Gesundheitsdatennutzugsgesetz (DGNG) berücksichtigt werden.
Die Nutzung der Daten des FDZ soll auf Antrag und unter Berücksichtigung des Zwecks der beabsichtigten Forschungs- und Entwicklungsaktivitäten möglich sein. Es sollte deshalb zum Beispiel möglich sein Daten schnell nutzen zu können, wenn die geplante Nutzung der Daten sich von bereits genehmigten Vorhaben wenig oder gar nicht unterscheidet. In solchen Fällen sollte eine Anmeldung beim FDZ ausreichen und auf eine zeitaufwändige Prüfung des Vorhabens durch das FDZ verzichtet werden. Das FDZ sollte für diese Fälle ein transparentes Verfahren definieren, damit Forscher und Entwickler für die Planung ihrer Projekte verlässliche Bedingungen haben.
Folge 91: Wichtige Atempause bei der Anwendung der MDR

Die Institutionen der Europäischen Union haben in einem beschleunigten Verfahren eine Anpassung der Übergangsfristen der EU-Verordnung über Medizinprodukte (MDR) verabschiedet. Seit der ersten Ankündigung der Europäischen Kommission zu dieser Maßnahme im Dezember 2022 bis zur Verabschiedung durch das Europäische Parlament und den Ministerrat hat es nur knapp drei Monate gedauert. Am 20. März 2023 wurde die Änderung der MDR im Amtsblatt der EU veröffentlicht. Sie ist damit in Kraft getreten und ab sofort anwendbar.
Die schnelle Verabschiedung zeigt, dass Europäische Kommission und Mitgliedstaaten die massiven Probleme bei der Anwendung der MDR erkannt haben. Es ist praktisch unmöglich alle Bestandsprodukte nach früher geltenden EU-Richtlinie über Medizinprodukte bis zum Mai 2024 in die MDR zu überführen. Die jetzt beschlossenen Änderungen sind eine wichtige Atempause bei der Anwendung der MDR auf Bestandsprodukte!
Aber auch bei neu entwickelten Medizinprodukten dauern die Konformitätsbewertungen viel zu lang. Hier droht ein Nachteil für den Medizintechnik-Standort Europa zu entstehen. In den nächsten Monaten müssen deshalb weiterhin pragmatische Lösungen gefunden werden, mit denen die Prozesse rund um die Anwendung der MDR dauerhaft beschleunigt werden können.
Behörden, Benannte Stellen und Industrie müssen ein gemeinsames Verständnis entwickeln, welche Dokumentation und welche Prüfschritte im Rahmen einer Konformitätsbewertung notwendig und ausreichend sind. Dieses Verständnis muss auf europäischer Ebene kommuniziert und durchgesetzt werden.
Folge 90: Digitalisierungs-Strategie Gesundheit konsequent umsetzen

Die Digitalisierungsstrategie, die hat Minister Lauterbach am 9. März 2023 vorgestellt hat, ist ein wichtiges Element für eine zukunftsfähige Gesundheitsversorgung in Deutschland. Gesundheitsdaten sollen umfassend für die medizinische Versorgung und die Forschung und Entwicklung genutzt werden.
Die industrielle Gesundheitswirtschaft erbringt in Deutschland den größten Anteil der Forschung und Entwicklung im Bereich Gesundheit. Es ist deshalb wichtig, dass auch die Industrie jetzt die Möglichkeit erhalten soll mit Daten aus dem Forschungsdatenzentrum zu arbeiten. Innovative Produkte und Dienstleistungen für die Gesundheitsversorgung können damit in Deutschland entwickelt werden.
Die erfolgreiche Digitalisierung des deutschen Gesundheitssystems braucht aber nicht nur klare Regeln für die Nutzung von Gesundheitsdaten. Ebenso wichtig ist es eine vernetzte Gesundheitsinfrastruktur aufzubauen, mit der die Daten effektiv für eine bessere und individualisierte Gesundheitsversorgung eingesetzt werden können.
Bei der konsequenten Umsetzung der Digitalisierungsstrategie Gesundheit darf dieser Punkt nicht vergessen werden.
Folge 89: 30 Jahre Europäischer Binnenmarkt - Erfolgsgeschichte für deutsche Elektromedizin

1993 hat die Europäische Union den „Europäischen Binnenmarkt“ gestartet. In vielen Bereichen wurden durch EU-Richtlinien die Schranken für den Handel zwischen den Mitgliedstaaten abgebaut, um die wirtschaftliche Entwicklung der EU zu unterstützen. Eine der ersten dieser sogenannten „Binnenmarkt-Richtlinien“ ist die Richtlinie 93/42/EWG des Rates über Medizinprodukte vom 14. Juni 1993 gewesen. Die Entwicklung der letzten 30 Jahre zeigt, dass der „Europäische Binnenmarkt“ für die deutschen Hersteller von elektromedizinischer Technik eine Erfolgsgeschichte ist.
Die deutschen Hersteller von elektromedizinischer Technik haben vom „Europäischen Binnenmarkt“ besonders profitiert. Seit 1993 sind die Lieferungen in die Länder der heutigen EU (inkl. GB) von damals 667 Millionen Euro um das Neunfache gestiegen. Die Dynamik hat dabei weder über den Verlauf der 30 Jahre und noch durch die wachsende Zahl der Mitgliedstaaten der EU abgenommen.
Mit 38,1% der Exporte bleibt mehr als ein Drittel der Ausfuhren von elektromedizinischer Technik in den Ländern der Europäischen Union. Mit 26,6 % nehmen die Länder der Eurozone dabei den größten Teil der Ausfuhren in die EU auf. Der „Europäische Binnenmarkt“ insgesamt betrachtet hat für die deutschen Hersteller damit im Vergleich eine größere Bedeutung als die international wichtigsten Einzelmärkte in den USA und China.
Folge 88: Digitalisierungsstrategie Gesundheitswesen und Pflege – technische Infrastruktur muss berücksichtigt werden

Krankenhausreform gelingt nur mit zielgerichteten Investitionen in eine vernetzte Gesundheitsinfrastruktur
Die Überlegungen für die grundlegende Reform der Krankenhausstrukturen in Deutschland lassen eine stärkere Spezialisierung der Krankenhäuser und eine höhere Vernetzung zwischen Krankenhäusern unterschiedlicher Versorgungsstufen und den Versorgungsangeboten in Arztpraxen und Medizinischen Versorgungszentren erwarten. Die medizinische Versorgung kann dann besser am Bedarf vor Ort ausgerichtet werden. Eine stärkere Integration der Angebote von Krankenhäusern und Arztpraxen ist auch zum Vorteil der Patientinnen und Patienten.
Die Reform kann aber nur gelingen, wenn sie mit zielgerichteten Investitionen in eine vernetzte Gesundheitsinfrastruktur begleitet wird. Die Krankenhäuser müssen mit moderner und kommunikationsfähiger Medizintechnik ausgestattet werden, die integrierte Versorgungsprozesse unterstützen kann. Außerdem müssen Investitionen in die Digitalisierung der Krankenhäuser finanziert werden, damit Informationen zwischen Krankenhäusern, Arztpraxen und anderen Beteiligten der medizinischen Versorgung wie der Pflege digital ausgetauscht werden können.
Die Krankenhausreform muss deshalb mit Investitionsprogrammen der Länder und mit einer Neuauflage des Krankenhauszukunftsfonds begleitet werden.
Folge 87: Die deutsche MedTech-Branche wächst weiter und ist stark exportorientiert

Bei der Umsatz- bzw. Exportentwicklung entsprechen die positiven Werte der Elektromedizin ihrem langfristigen, stabilen Trend, der im Gegensatz zur Gesamtelektroindustrie derzeit keine Sonderkonjunktur anzeigt. Zum Beschäftigtenanstieg in Deutschland trägt die Elektromedizin ebenso traditionell überdurchschnittlich stark bei, diesmal doppelt so hoch.
Die Zahlen (Januar bis November 2022)
- Umsatz 12,4 Mrd. Euro
- Exporte 14,6 Mrd. Euro
- Beschäftigungsplus: 44.300
Folge 86: Anpassung der MDR – schnelle Umsetzung und weitere Schritte notwendig

Am 6. Januar 2023 hat die Europäische Kommission Vorschläge zur Anpassung der EU-Verordnung für Medizinprodukte (MDR) vorgelegt. Mit der Anpassung soll verhindert werden, dass Medizinprodukte ab dem 27. Mai 2024 aus bürokratischen Gründen nicht mehr für die Gesundheitsversorgung verfügbar sind. An diesem Termin endet die letzte Übergangsfrist zur Anwendung der MDR. Mediziner weisen bereits seit langem auf diese Gefahr hin.
Die MDR fordert, das alle Medizinprodukte ein neues Konformitätsbewertungsverfahren auf Basis der MDR durchlaufen müssen. Das gilt auch für Bestandsprodukte, die bereits seit langem am Markt sind. Diese Bestandsprodukte tragen eine CE-Kennzeichnung nach der bisher gültigen EU-Richtlinie für Medizinprodukte (MDD). Die Benannten Stellen haben allerdings nicht genügend Kapazität, um alle Bestandsprodukte einer neuen Konformitätsbewertung nach der MDR zu unterziehen.
Die Europäische Kommission schlägt deshalb vor, den Zeitraum, bis zu dem Bestandsprodukte die neue Konformitätsbewertung durchlaufen müssen, bis zum Jahr 2027 und 2028 zu verlängern. Voraussetzung ist, dass die Hersteller bis September 2024 eine schriftliche Vereinbarung mit einer Benannten Stelle getroffen haben. Außerdem sollen bereits produzierte Medizinprodukte mit einer CE-Kennzeichnung auf Basis der MDD ohne zeitliche Begrenzung in den Mitgliedstaaten der Europäischen Union in Verkehr gebracht werden können.
Der Vorschlag der Europäischen Kommission zur Anpassung der MDR kann verhindern, dass Medizinprodukte im Mai 2024 aus bürokratischen Gründen nicht mehr für die Gesundheitsversorgung zur Verfügung stehen. Das Europäische Parlament und die Mitgliedstaaten sollten den Vorschlag deshalb schnell verabschieden. Ebenso schnell müssen aber wichtige Details zur praktischen Anwendung der neuen Regelungen geklärt werden. Nur so kann diese Anpassung der MDR Engpässe bei der Versorgung mit Medizinprodukten in Europa verhindern.
MedTech-Telegram 2022
Folge 85: Mit Round Table Gesundheitswirtschaft internationale Wettbewerbsfähigkeit stärken

Das Bundesministerium für Wirtschaft und Klimaschutz hat Ende November den „Round Table Gesundheitswirtschaft“ gestartet. Mit den Verbänden der industriellen Gesundheitswirtschaft wird im „Round Table Gesundheitswirtschaft“ diskutiert, wie Deutschland seine Position als international wettbewerbsfähiger Standort für Unternehmen der industriellen Gesundheitswirtschaft stärken kann.
Deutschland gehört zu den führenden Lieferanten von Medizintechnik der Welt. Gut 70 Prozent des Umsatzes erzielen deutsche Hersteller von Medizintechnik im Export. Damit dies auch in Zukunft so bleibt, muss an den Rahmenbedingungen in Deutschland gearbeitet werden. Der ZVEI und die anderen Verbände der medizintechnischen Industrie streben im „Round Table Gesundheitswirtschaft“ eine strategische Resilienz des Medizintechnik-Standorts Deutschland an, wollen die Innovationskraft der Branche durch Bürokratieabbau und klare Regeln für die Nutzung von Gesundheitsdaten stärken und eine Strategie für ein nachhaltiges Gesundheitssystem auf den Weg bringen. Gemeinsam mit dem bvitg wird sich der ZVEI im „Round Table Gesundheitswirtschaft“ auch dafür einsetzen, durch klare Rahmenbedingungen das Wachstum im Bereich digitale Gesundheit in Deutschland zu fördern.
Folge 84: Weniger als die Hälfte der CT- und MRT-Geräte in Deutschland sind jünger als fünf Jahre

Die Altersstruktur medizintechnischer Geräte hat sich in den vergangenen Jahren stetig verschlechtert. So sind etwa über die Hälfte der Computertomographen in Deutschland laut einer Cocir-Studie älter als sechs Jahre, 20 Prozent sogar älter als zehn Jahre. Ähnlich sieht es bei Röntgengeräten aus: Hier sind zwei Drittel älter als sechs Jahre, 30 Prozent älter als zehn Jahre. Damit moderne digitale Prozesse in der Gesundheitsversorgung erfolgreich und flächendeckend angewendet werden können, müssen medizintechnische Geräte diese Prozesse auch unterstützen können. Die Geräte allerdings, die älter als sechs Jahre sind, können nicht optimal in diese integriert werden. Dadurch werden moderne datenbasierte Behandlungsabläufe unterbrochen oder verzögert – und damit auch die digitale Transformation der Gesundheitsversorgung.
Folge 83: Die deutsche MedTech-Branche wächst weiter und ist stark exportorientiert

Die schwierige weltwirtschaftliche Lage und anhaltende Einschränkungen durch die Corona-Pandemie haben die globale Nachfrage nach Produkten zur Ausstattung der Gesundheitssysteme nicht beeinträchtigt. Deutschlands Export von elektromedizinischer Technik wächst deshalb weiter. Das gesamte Auslandsgeschäft belief sich 2019 auf rund 15,0 Milliarden Euro und ist 2021 auf über 16,6 Milliarden Euro gestiegen. Auch die jüngsten Außenhandelsdaten für die ersten drei Quartale dieses Jahres bestätigen den anhaltenden Wachstumspfad für Elektromedizin „Made in Germany“. Insgesamt ist der Export für den Zeitraum Januar bis September von 11,4 Milliarden Euro im Jahr 2021 auf 11,7 Milliarden Euro in diesem Jahr gestiegen. Wachstumstreiber sind der global stattfindende demografische Wandel, die digitale Transformation in der medizinischen Versorgung und die immer genauer am Bedarf der Anwender ausgerichteten Angebote der Industrie.
Folge 82: MDR und AI Act - Widersprüchliche Regelungen für Medizinprodukte mit KI verhindern

Der Einsatz Künstlicher Intelligenz (KI) gewinnt in der Gesundheitswirtschaft immer stärker an Bedeutung. KI ist dabei nicht nur ein Instrument für die medizinische Wissenschaft und Forschung. Auch in der Gesundheitsversorgung spielen Software-Lösungen, die auf KI beruhen, eine immer größere Rolle. Die EU-Verordnung über Medizinprodukte (MDR) trägt dem bereits Rechnung. Software kann ein eigenständiges Medizinprodukt sein, dass die Anforderungen der MDR erfüllen muss. Dabei wird ein risikobasierter Ansatz verfolgt. Die Besonderheiten von KI-Anwendungen werden dabei berücksichtigt.
Der Entwurf der europäischen Kommission für eine Verordnung zum Thema KI (AI Act) soll dagegen für KI-Anwendungen aller Art in der EU einen verlässlichen Rechtsrahmen schaffen. Der Vorschlag betrachtet dabei ebenfalls die Risiken, die bei diesen unterschiedlichen KI-Anwendungen zu beachten sind. Ziel ist es, dadurch das Vertrauen der Menschen in die verschiedenen Anwendungen zu stärken. Medizinprodukte liegen im Anwendungsbereich des AI Act. Der AI Act würde dann zusätzlich zu den Anforderungen der MDR gelten. Das kann zu widersprüchlichen Anforderungen führen.
Die MDR ist bereits seit 26. Mai 2021 gültig und wird für neue Medizinprodukte mit KI bereits angewendet. Die Beratungen zum AI Act dauern dagegen noch an. Es muss verhindert werden, dass nachgewiesen wirksame KI-Anwendungen für die Gesundheitsversorgung auf Basis der MDR in der EU auf den Markt gebracht werden können und in der Zukunft möglicherweise wegen Widersprüchen zum AI Act wieder vom Markt genommen werden müssen.
Die MDR regelt bereits umfassend die Anforderungen an die Sicherheit und Leistungsfähigkeit von Medizinprodukten mit KI. Ähnlich ist es mit der Verordnung der EU für In vitro-Diagnostik-Produkte (IVDR). Es ist deshalb sinnvoll, die MDR und die IVDR als spezifische Regulierungen in Artikel 2 Absatz 2 des AI Act aufzunehmen. Zusätzlich sollten die MDR und die IVDR in Anhang II Abschnitt B des AI Act aufgenommen werden. Hierfür sollte sich Deutschland bei den Beratungen zum AI Act im Kreis der Mitgliedstaaten einsetzen, um widersprüchliche Anforderungen an Medizinprodukte und In vitro-Diagnostik-Produkte zu verhindern.
Folge 81: Bruttowertschöpfung der industriellen Gesundheitswirtschaft 2021 wieder gestiegen

Die Ergebnisse der Gesundheitswirtschaftlichen Gesamtrechnung (GGR) für das Jahr 2021, die das Bundesministerium für Wirtschaft und Klimaschutz am 7. Oktober 2022 vorgestellt hat, zeigen die große wirtschaftliche Bedeutung der industriellen Gesundheitswirtschaft für Deutschland.
Die industrielle Gesundheitswirtschaft hat im Jahr 2021 eine Bruttowertschöpfung (BWS) von 85,2 Milliarden Euro in Deutschland erzeugt und damit den leichten Rückgang der BWS im Corona-Krisenjahr 2020 ausgeglichen. Die industrielle Gesundheitswirtschaft hat damit 21,7 Prozent zur gesamten BWS der Gesundheitswirtschaft beigetragen. Zum zweiten Mal in Folge hat die industrielle Gesundheitswirtschaft in Deutschland über eine Million Menschen beschäftigt. Das sind 13 Prozent der Beschäftigten der deutschen Gesundheitswirtschaft. Die Exporte der industriellen Gesundheitswirtschaft in Höhe von 145,5 Milliarden Euro machen 92 Prozent der Exporte der deutschen Gesundheitswirtschaft aus. Seit dem Jahr 2012 hat sich das Exportvolumen der iGW damit um das 1,6-Fache erhöht. Das durchschnittliche jährliche Wachstum der Exporte betrug dabei 5,7 Prozent.
Weitere Informationen zu den neuen Ergebnissen der GGR auf der Seite des BMWK - Gesundheitswirtschaft
Folge 80: Digitalisierungsstrategie Gesundheit und Pflege – Handlungsfelder zusammendenken

Im September ist das Bundesministerium für Gesundheit in die Erarbeitung der Digitalisierungsstrategie Gesundheit und Pflege gestartet. Damit die Strategie und ihre Umsetzung auf einen breiten Konsens gestützt sind, hat sich das BMG für einen partizipativen Prozess entschieden. Bis zum Jahresende soll der Prozess beendet sein. Die Strategie soll im Frühjahr 2023 vorgestellt werden.
Zu diesem Prozess gehören unter anderem eine breit angelegte Online-Befragung, mit der Ende September ein Stimmungsbild aller Interessierten erhoben wurde. Zudem wird fachliche Expertise über Interviews und Fachforen – in insgesamt acht identifizierten Handlungsfeldern – eingebunden.
Der ZVEI hat seine Sicht auf grundlegende Aspekte der digitalen Transformation bereits 2017 in seinem „Grünbuch Digitalisierung der Gesundheitswirtschaft“ dargestellt. Die Digitalisierung von Gesundheit und Pflege ist ein Prozess der Transformation, der über die Einführung einzelner Technologien und Anwendungen hinausgeht. Dieser Wandel bedeutet weitreichende Veränderungen, die in der Strategie berücksichtigt werden müssen.
Aus Sicht des ZVEI dürfen die acht Handlungsfelder deshalb nicht isoliert betrachtet werden. Vielmehr müssen auch die Wechselwirkungen zwischen den acht Handlungsfeldern erfasst und zu einem gemeinsamen Zielbild für die Digitalisierung von Gesundheit und Pflege zusammengeführt werden.
Folge 79: MDR – verbindliche Regelungen für Bestandsprodukte dringend notwendig

Seit Mai 2021 gilt inzwischen die EU-Verordnung für Medizinprodukte (MDR). Alle Medizinprodukte müssen eine Konformitätsbewertung für die CE-Kennzeichnung nach der MDR absolvieren – das gilt auch für sämtliche Bestandsprodukte. Gerade bei diesen besteht weiter die Gefahr, dass es in den nächsten beiden Jahren zu Engpässen bei der Versorgung in Deutschland und Europa kommt.
Artikel 120 der MDR regelt, dass Bestandsprodukte weiter nach der bisherigen EU-Richtlinie für Medizinprodukte in Verkehr gebracht werden dürfen, solange die entsprechenden Zertifikate der Benannten Stellen gültig sind. Diese Regelung endet aber spätestens am 27. Mai 2024. Einige Zertifikate können schon vor diesem Datum ihre Gültigkeit verlieren. Wenn bis dahin keine erneute Konformitätsbewertung nach der MDR erfolgt ist, darf das Medizinprodukt nicht mehr in Verkehr gebracht werden und steht dann für die Gesundheitsversorgung nicht mehr zur Verfügung.
Da es weiterhin nicht genügend Benannte Stellen gibt, die die Konformitätsbewertung begleiten müssen, haben die Hersteller große Probleme diese Zertifikate zu erneuern. Die „Medical Device Coordination Group“ (MDCG) der Europäischen Union hat Ende August das Dokument MDCG 2022-14 mit Empfehlungen zu „Notified body capacity and availability of medical devices and IVDs“ verabschiedet. Mit den Vorschlägen aus diesem Dokument soll diesen Problemen begegnet werden.
Allerdings müssen diese allgemeinen Empfehlungen jetzt schnell in verbindliche Regeln gefasst werden, damit in der Praxis die Basis für die verlässliche Durchführung der Konformitätsbewertung vorhanden ist. Behörden, Benannte Stellen und Hersteller müssen deshalb dringend gemeinsam diese Regeln festlegen, damit Bestandsprodukte bis spätestens 27. Mai 2024 die erneute Konformitätsbewertung nach der MDR absolvieren können.
Die Vorschläge der MDCG können dazu beitragen, die Situation zu erleichtern, sind aber nicht für alle Probleme bei der Anwendung der MDR eine Lösung. Die Anwendung der MDR in Deutschland und Europa muss deshalb weiter intensiv beobachtet werden.
Folge 78: Digitalisierungsstrategie Gesundheitswesen und Pflege – technische Infrastruktur muss berücksichtigt werden

Eine Digitalisierungsstrategie für den Gesundheitsbereich in Deutschland zu entwickeln, ist Teil des Koalitionsvertrags der Regierungsparteien. Mit der Auftaktveranstaltung am 7. September 2022 im Bundesministerium für Gesundheit wird diese Aufgabe jetzt begonnen. Bei der Ausgestaltung der sogenannten „Digitalisierungsstrategie Gesundheitswesen und Pflege“ müssen die vielen, teils komplexen Zusammenhänge unsere Gesundheitssystems beachtet werden. Prozesse und Regelungen müssen dabei auch die wachsende europäische, länderübergreifende Zusammenarbeit angemessen berücksichtigen.
Dazu zählt erstens, dass einzelne digitale Anwendungen für Gesundheit und Pflege nicht isoliert betrachtet werden. Sie müssen in der Digitalisierungsstrategie mit dem Ziel einer sektorübergreifenden und individualisierten Gesundheitsversorgung zusammengeführt werden. Die medizinische Versorgung in Krankenhaus und Arztpraxis sowie ambulante und stationäre Pflege müssen in der geplanten Strategie miteinander verbunden betrachtet werden.
Nur wenn Medizintechnik und IT-Systeme miteinander vernetzt sind, können zweitens relevante medizinische Daten und Informationen geteilt und für die Gesundheitsversorgung und Pflege genutzt werden. Dies ist technische Voraussetzung für die stärkere Nutzung von Telemedizin und sektorübergreifender Versorgung. Ein Teil der Strategie muss deshalb auch der Aufbau einer flächendeckenden vernetzten Gesundheitsinfrastruktur aus Medizintechnik und IT-Systemen sein.
Medizintechnische Geräte sind die Quelle für viele Daten, die für die Gesundheitsversorgung und die Pflege von Patientinnen und Patienten relevant sind. Diese Daten müssen reibungslos an die IT-Systeme weitergegeben werden, mit denen die Abläufe in der Gesundheitsversorgung und Pflege organisiert und gesteuert werden. So können drittens integrierte Behandlungspfade für Patientinnen und Patienten realisiert werden, bei denen auch die individuellen Lebensumstände berücksichtigt werden können.
Das BMG will die verschiedenen Akteure im Gesundheitsbereich und der Pflege, Patientinnen und Patienten sowie Pflegebedürftige und deren Angehörige in die Entwicklung der Strategie einbinden. Geplant ist ein offener und partizipativer Prozess, in dem die verschiedenen Perspektiven und Anregungen durch Beteiligungs- und Dialogformate aufgenommen und zu einer Strategie entwickelt werden. Der ZVEI setzt sich dafür ein, dass auch der Aufbau der vernetzten Gesundheitsinfrastruktur bedacht wird.
Folge 77: Gesundheitsdatennutzungsgesetz und EHDS – Einbindung schon jetzt mitdenken

Im Mai hat die Europäische Kommission den Vorschlag für die „Verordnung über den europäischen Raum für Gesundheitsdaten“ vorgelegt. Mit der Verordnung soll ein europäischer Raum für Gesundheitsdaten (European Health Data Space – EHDS) mit Vorschriften, gemeinsamen Standards und Verfahren, Infrastrukturen und einem Governance-Rahmen für die Primär- und Sekundärnutzung elektronischer Gesundheitsdaten geschaffen werden. Elektronische Gesundheitsdaten sollen EU-weit grenzüberschreitend sowohl in der medizinischen Versorgung aber auch für die Forschung (Sekundärnutzung) verwendet werden können.
Die Regelungen zum EHDS werden Einfluss auf den Umgang mit elektronischen Gesundheitsdaten in Deutschland nehmen. Bei der Entwicklung des geplanten deutschen Gesundheitsdatennutzungsgesetzes muss deshalb die europäische Diskussion zum EHDS mit beachtet werden. Elektronische Gesundheitsdaten aus Deutschland müssen für die primäre und sekundäre Nutzung im EHDS zur Verfügung stehen. In Deutschland sollten diese Daten mindestens im gleichen Umfang genutzt werden können, um die datenbasierte Forschung in der Gesundheitswirtschaft am Standort Deutschland zu stärken. Es ist deshalb im Interesse Deutschlands bei neuen nationalen Regelungen zur Nutzung elektronischer Gesundheitsdaten bereits jetzt die Modelle anderer EU-Mitgliedstaaten zu beachten.
Folge 76: Vernetzte Gesundheitsinfrastruktur ist Grundlage für erfolgreiche Digitalisierung

Die Arbeit an der “regelmäßig fortgeschriebenen Digitalisierungsstrategie im Gesundheitswesen”, wie sie im Koalitionsvertrag angekündigt wurde, soll bald aufgenommen werden. Die bisherigen Entscheidungen zu DiGA, ePA und eRezept sind notwendige Schritte für eine digitale Transformation der Gesundheitsversorgung in Deutschland. Diese einzelnen Anwendungen dürfen aber nicht isoliert betrachtet werden. Sie müssen in der Digitalisierungsstrategie mit dem Ziel einer sektorübergreifenden und individualisierten Gesundheitsversorgung zusammengeführt werden.
Zentral für die erfolgreiche digitale Transformation ist eine vernetzte Gesundheitsinfrastruktur. Nur wenn Medizintechnik und IT-Systeme miteinander vernetzt sind, können relevante medizinische Daten und Informationen geteilt und für die Gesundheitsversorgung genutzt werden. Dies ist technische Voraussetzung für die stärkere Nutzung von Telemedizin und sektorübergreifender Versorgung. So kann ein integrierter Behandlungspfad für Patientinnen und Patienten aufgesetzt werden und nicht bei jedem Arztbesuch müssen sämtliche Untersuchungen neu gemacht werden.
Das Krankenhauszukunftsgesetz war für diese Transformation bereits ein wichtiger erster Schritt. Mit dem angeschlossenen Krankenhaus-Zukunftsfonds wurden Investitionen in die Modernisierung und Digitalisierung der Infrastruktur von Krankenhäusern gefördert. In den kommenden Jahren sind aber noch weitere Investitionen notwendig.
Die Digitalisierungsstrategie muss deshalb konkret auch den Aufbau einer vernetzten Gesundheitsinfrastruktur einschließen.
Mehr zur Digitalisierung in der Gesundheitswirtschaft auch in den MedTech-Telegrams Nr. 56, 63, 67 und 74.
Weitere grundlegende Gedanken des ZVEI dazu finden sich auch in den „20 Vorschlägen für eine erfolgreiche digitale Transformation der Gesundheitsversorgung“
Folge 75: Nur noch 2 Jahre, um Engpässe bei Medizinprodukten auszuschließen

Seit einem Jahr gilt inzwischen die EU-Verordnung für Medizinprodukte (MDR). Alle Medizinprodukte müssen eine Konformitätsbewertung für die CE-Kennzeichnung nach der MDR absolvieren – das gilt auch für sämtliche Bestandsprodukte. Gerade bei diesen besteht nun die Gefahr, dass es in den nächsten beiden Jahren zu Engpässen bei der Versorgung in Deutschland und Europa kommen kann.
Denn noch immer ist das System zur Anwendung der MDR nicht voll funktionsfähig. Behörden, Benannte Stellen und Hersteller müssen dringend gemeinsam daran arbeiten, dass Bestandsprodukte bis spätestens 27. Mai 2024 die erneute Konformitätsbewertung nach der MDR absolvieren können. Derzeit verzögert sich diese erheblich, da es weiterhin nicht ausreichend Benannte Stellen gibt. Zudem fehlen verschiedene Rechtsakte zur Durchführung der MDR. Die Möglichkeit besteht damit, dass viele Zertifikate für Bestandsprodukte auslaufen, bevor eine Konformitätsbewertung nach der MDR möglich ist.
Aktuell ist die Versorgung mit Medizinprodukten nicht gefährdet. Aber: Um die Verfügbarkeit von Bestandsprodukten und damit die Gesundheitsversorgung nachhaltig zu sichern, müssen Behörden und Hersteller in Deutschland und der EU jetzt gemeinsam handeln.
Artikel 120 der MDR regelt, dass Bestandsprodukte weiter nach der bisherigen EU-Richtlinie für Medizinprodukte in Verkehr gebracht werden dürfen, solange die entsprechenden Zertifikate der Benannten Stellen gültig sind. Diese Regelung endet aber spätestens am 27. Mai 2024. Einige Zertifikate können schon vor diesem Datum ihre Gültigkeit verlieren. Wenn bis dahin keine erneute Konformitätsbewertung nach der MDR erfolgt ist, darf das Medizinprodukt nicht mehr in Verkehr gebracht werden und steht dann für die Gesundheitsversorgung nicht mehr zur Verfügung.
Folge 74: Digitalisierungsstrategie für Gesundheitsversorgung muss bisherige Maßnahmen zusammenführen

Noch in diesem Jahr soll die Entwicklung der im Koalitionsvertrag angekündigten “regelmäßig fortgeschriebenen Digitalisierungsstrategie im Gesundheitswesen” beginnen.
In der vergangenen Legislaturperiode hat das Bundesministerium für Gesundheit bereits einige Gesetze zur Förderung der Digitalisierung der Gesundheitsversorgung angestoßen. Diese haben die richtigen Maßnahmen eingeleitet, um die Gesundheitsversorgung mit digitalen Lösungen zu verbessern:
- Digitale-Versorgung-Gesetz: Digitale Gesundheitsanwendungen (DiGA) sind jetzt Teil der Regelversorgung und können für Patienten und medizinisches Personal die Versorgung verstetigen.
- Patientendaten-Schutz-Gesetz: Ab dem Jahr 2021 haben Versicherte der Gesetzlichen Krankenversicherung Anspruch auf eine elektronische Patientenakte (ePA). Relevante medizinische Informationen können dann jederzeit genutzt werden.
- Krankenhauszukunftsgesetz: Mit der Finanzierung aus dem Krankenhaus-Zukunftsfonds kann die Infrastruktur von Krankenhäusern modernisiert und digitalisiert werden. Telemedizin und sektorübergreifende Versorgung können dann stärker genutzt werden.
- Gesetz zur digitalen Modernisierung von Versorgung und Pflege (DVPMG): Erste Entwicklungen im Bereich der digitalen Pflegeanwendungen und Telemedizin.
Zudem sieht die Planung des Bundesministeriums für Gesundheit noch in diesem Jahr den Rollout des E-Rezepts sowie die Klärung der Einzelheiten zur Ausgestaltung der Opt-Out-Lösung für die elektronische Patientenakte vor.
All diese einzelnen Schritte sind notwendig für eine erfolgreiche digitale Transformation der Gesundheitsversorgung. Doch in der Digitalisierungsstrategie müssen diese Schritte nun zusammengeführt und nicht mehr isoliert betrachtet werden. Sie müssen sich gegenseitig unterstützen, um das Ziel einer individualisierten Gesundheitsversorgung zu erreichen. Das „Innovationsforum Digitale Gesundheit 2025“ des BMG, an dem sich auch der ZVEI beteiligt hat, hat gezeigt, wie ein solches Ergebnis erreicht werden kann. Es ist positiv, dass auch für die Entwicklung der Digitalisierungsstrategie nun ein breit angelegter Beteiligungsprozess geplant ist.
Weitere grundlegende Gedanken des ZVEI dazu finden sich auch in den „20 Vorschlägen für eine erfolgreiche digitale Transformation der Gesundheitsversorgung“.
Folge 73: MedTech-Branche – dynamisch und exportorientiert

Die Nachfrage von Medizintechnik ist weltweit sehr groß und steigt kontinuierlich an. So ist der Gesamtumsatz der Medizintechnik seit 2012 von 24 Milliarden Euro auf rund 34 Milliarden Euro in 2020 angestiegen. Im Jahr 2020 betrug der Inlandsumsatz insgesamt 11,7 Milliarden Euro und der Auslandsumsatz 22,6 Milliarden Euro.
Seit vielen Jahren liegt die Exportquote der Branche bei zwei Dritteln des Gesamtumsatzes. Dies unterstreicht die Bedeutung deutscher Medizintechnik auf dem Weltmarkt.
Folge 71: Deutschland ist zweitgrößter MedTech-Produzent weltweit

Das weltweite Produktionsvolumen für Medizintechnologien betrug 2018 rund 390 Milliarden US-Dollar. Mit einem Anteil von 38,9 Prozent waren die USA der größte Akteur auf internationaler Ebene. Dahinter folgt Deutschland mit 9,9 Prozent vor Japan mit 8,9 Prozent der weltweiten Medizintechnikproduktion.
Folge 70: Die Gesundheitswirtschaft ist trotz Pandemie eine stabile Branche

Mit einer Bruttowertschöpfung von über 365 Milliarden Euro, das sind etwa 12 Prozent des Bruttoinlandprodukts (BIP), und einem Exportanteil von über acht Prozent an der Gesamtwirtschaft ist die Gesundheitswirtschaft einer der größten Wirtschaftszweige in Deutschland und ein Stabilisator in der Pandemie. Zur Gesundheitswirtschaft zählen stationäre Einrichtungen, wie z. B. Krankenhäuser, nicht-stationäre, z. B. Arztpraxen sowie die industrielle Gesundheitswirtschaft und die medizinische Versorgung, d. h. Apotheken.
Die MedTech-Branche wiederum ist ein bedeutender Teil der industriellen Gesundheitswirtschaft. Mit einer Bruttowertschöpfung von 13,2 Milliarden Euro hat die Branche sich zu einem Kernstück der industriellen Gesundheitswirtschaft herauskristallisiert. Mit einem Exportanteil in Höhe von rund 28 Prozent an der gesamten deutschen Gesundheitswirtschaft leistet die MedTech-Branche einen hohen Beitrag zum gesamtwirtschaftlichen Wohlstand und ist damit auch wesentlicher Bestandteil der Wertschöpfungskette Deutschlands.
Folge 69: Die Gesundheitswirtschaft schafft und sichert langfristig Arbeitsplätze

Die deutsche Gesundheitswirtschaft insgesamt ist ein Arbeitsplatzmotor. Mit rund 7,4 Millionen Beschäftigten und einem Anteil von 16,3 Prozent am gesamten deutschen Arbeitsmarkt ist die Gesundheitswirtschaft inbesondere in Zeiten der Corona-Pandemie ein stabiler Faktor für sichere Arbeitsplätze.
Die deutsche MedTech-Branche, zu der auch die elektromedizinische Technik zählt, ist dabei ein bedeutender Teil der industriellen Gesundheitswirtschaft. Neben rund 194.000 Erwerbstätigen sind darüber hinaus weitere 200.000 bis 250.000 Arbeitsplätze indirekt mit der MedTech-Branche verbunden. Die wirtschaftliche Aktivität der Branche hat damit einen überdurchschnittlich hohen Ausstrahleffekt für den gesamten deutschen Arbeitsmarkt.
MedTech-Telegram 2021
Folge 68: Position der Medizintechnik-Branche in Deutschland langfristig sichern

Medizintechnik leistet einen wesentlichen Beitrag für eine moderne und leistungsfähige Gesundheitsversorgung. Das ist auch während der Corona-Pandemie sichtbar geworden. Die deutsche Medizintechnik-Branche ist innovativ und international erfolgreich. Diese Position muss für die Zukunft aber gesichert werden. Dafür haben die Verbände BVMed, Spectaris und ZVEI gemeinsam das "Zielbild Medizintechnik 2025" formuliert.
Ziel ist, dass es im Jahr 2025 in Deutschland eine forschungsstarke, leistungsfähige, wirtschaftlich gesunde und international wettbewerbsfähige Medizintechnikbranche gibt, deren Unternehmen innovative Produkte entwickeln und produzieren sowie auf dem Heimatmarkt und international erfolgreich vermarkten, weil in Deutschland und der EU die richtigen Rahmenbedingungen herrschen.
Die Medizintechnik in Deutschland steht vor vielfältigen Herausforderungen, für die in den kommenden Jahren nachhaltige Antworten am Standort Deutschland gefunden werden müssen. Das „Zielbild Medizintechnik 2025” benennt fünf Handlungsfelder und macht Vorschläge, wie die Rahmenbedingungen in Deutschland verbessert werden können. Dafür ist auch eine koordinierte Unterstützung durch die Politik notwendig.
Folge 67: Fortschritte auf dem Weg zur vernetzten Gesundheitsinfrastruktur?

In den vergangenen beiden Jahren haben mehrere Gesetze die Digitalisierung im deutschen Gesundheitssystem in Bewegung gebracht. Nach Digitalen Gesundheitsanwendungen (DiGA) und der elektronischen Patientenakte (ePA) sollen nun auch im Bereich der Pflege die Anwendung digitaler Lösungen unterstützt werden. Aber wo steht Deutschland beim Aufbau einer vernetzten Gesundheitsinfrastruktur für den gesamten Prozess der Gesundheitsversorgung?
Bisher sind nur einzelne digitale Anwendungen gesetzlich geregelt – punktuell und abgegrenzt. Vorhandene Daten für weitere digitale Anwendungen zu nutzen, ist immer noch nicht möglich, denn es gibt keinen umfassenden Rechtsrahmen für die Nutzung von Daten im deutschen Gesundheitssystem. Die digitale Unterstützung eines vollständigen Versorgungsprozesses über Sektoren hinweg und über die gesamte Dauer der Behandlung, also eine digitale integrierte Versorgung, liegt weiter in der Zukunft.
Die bisherigen gesetzlichen Regelungen zur Digitalisierung des deutschen Gesundheitssystems müssen deshalb jetzt mit einer Strategie zum Aufbau einer vernetzten Gesundheitsinfrastruktur ergänzt werden. Dabei muss die Medizintechnik als Teil der Gesundheitsinfrastruktur mit einbezogen werden. In einer vernetzten Gesundheitsinfrastruktur ist die Medizintechnik sowohl Quelle als auch Nutzer von Daten im Rahmen der Versorgung.
Beim Aufbau einer digitalen Gesundheitsinfrastruktur, die Gesundheitsdaten nicht nur erzeugt, sondern auch für eine bessere medizinische Versorgung einsetzen kann, steht Deutschland erst am Anfang des Wegs.
Mehr dazu auch in den Medtech-Telegrams Nr. 56 und 63.
Folge 66: MDR Endspurt – jetzt Versorgung mit Medizinprodukten gemeinsam nachhaltig sichern

Am 26. Mai 2021 beginnt die Geltung der EU-Verordnung für Medizinprodukte (MDR) für alle Medizinprodukte. Ab diesem Datum dürfen in der EU nur noch Medizinprodukte in Verkehr gebracht werden, die diese Anforderungen erfüllen. Dafür müssen alle Medizinprodukte eine erneute Konformitätsbewertung absolvieren – das gilt auch für sämtliche Bestandsprodukte.
Um die Versorgung mit Medizinprodukten und damit die Gesundheitsversorgung nachhaltig zu sichern, müssen Behörden und Hersteller in Deutschland und der EU jetzt gemeinsam handeln. Denn das System zur Umsetzung der MDR ist auch am Ende der Übergangsfrist (in Kraft ist die MDR bereits seit 2017) noch nicht voll funktionsfähig: Es gibt zu wenige Benannte Stellen und eine Reihe von Rechtsakten zur Durchführung der MDR fehlen ebenfalls weiterhin.
Warum beginnt jetzt der Endspurt? Ein Beispiel: Artikel 120 der MDR regelt, dass Bestandsprodukte weiter nach der bisherigen EU-Richtlinie für Medizinprodukte in Verkehr gebracht werden dürfen, solange die entsprechenden Zertifikate der Benannten Stellen gültig sind. Diese Regelung endet aber auch spätestens am 27. Mai 2024. Einige Zertifikate können schon vor diesem Datum ihre Gültigkeit verlieren. Wenn bis dahin keine erneute Konformitätsbewertung erfolgt ist, darf das Medizinprodukt nicht mehr in Verkehr gebracht werden. und steht dann für die Gesundheitsversorgung nicht mehr zur Verfügung.
Panik ist vorerst unbegründet. Die Versorgung mit Medizinprodukten ist zumindest vorübergehend nicht gefährdet. Dennoch: Behörden, Benannte Stellen und medizinische Anwender müssen die Situation aufmerksam beobachten, damit mögliche Engpässe früh erkannt werden. Behörden, Benannte Stellen und Hersteller müssen parallel dazu gemeinsam daran arbeiten, dass alle Medizinprodukte bis spätestens 27. Mai 2024 die erneute Konformitätsbewertung absolvieren können.
Der Geltungsbeginn der MDR am 26. Mai 2021 ist damit auch der Startschuss für den Endspurt zur erfolgreichen Durchführung der MDR.
Folge 65: KI-Verordnung der EU muss widersprüchliche Regelungen für Gesundheitswirtschaft vermeiden

Der Einsatz Künstlicher Intelligenz (KI) gewinnt in der Gesundheitswirtschaft immer stärker an Bedeutung. KI ist aber nicht nur ein Instrument für die medizinische Wissenschaft und Forschung. Auch in der Gesundheitsversorgung spielen Software-Lösungen, die auf KI beruhen, eine immer größere Rolle. Die EU-Verordnung über Medizinprodukte (MDR) trägt dem bereits Rechnung. Software kann ein eigenständiges Medizinprodukt sein, dass die Anforderungen der MDR erfüllen muss. Dabei wird ein risikobasierter Ansatz verfolgt.
Der Entwurf der europäischen Kommission für eine Verordnung zum Thema KI soll einen verlässlichen Rechtsrahmen für KI-Anwendungen aller Art in der EU schaffen. Der Vorschlag betrachtet dabei ebenfalls die Risiken, die bei diesen unterschiedlichen KI-Anwendungen zu beachten sind. Ziel ist es, dadurch das Vertrauen der Menschen in die verschiedenen Anwendungen zu stärken.
Für die Gesundheitswirtschaft ist es nun immens wichtig, dass die Regelungen der MDR und der geplanten KI-Verordnung aufeinander abgestimmt sind und keine widersprüchlichen Anforderungen stellen. Der Geltungsbeginn der MDR ist bereits der 26. Mai 2021, während die Beratungen zur KI-Verordnung gerade erst begonnen haben. Es muss verhindert werden, dass nachgewiesen wirksame KI-Anwendungen für die Gesundheitsversorgung auf Basis der MDR eingeführt werden und in der Zukunft wegen möglicher Widersprüche zur KI-Verordnung angepasst oder sogar vom Markt genommen werden müssen.
Folge 64: Deutsche elektromedizinische Technik bleibt international wettbewerbsfähig

Die ersten Zahlen zum deutschen Außenhandel im Jahr 2020 zeigen, dass die elektromedizinische Industrie in Deutschland auch unter den schwierigen Pandemie-Bedingungen international wettbewerbsfähig geblieben ist. Das Exportgeschäft ist für deutsche Hersteller elektromedizinische Hersteller ein enorm wichtiges Standbein. Sie erzielen damit über zwei Drittel ihres Umsatzes.
Trotz stark gedämpftem weltweitem Wachstum und beeinträchtigter internationaler Lieferketten, haben die Exporte aus Deutschland in 2020 gegenüber dem Jahr 2019 um fünf Prozent zugenommen. Die Importe nach Deutschland sind im selben Zeitraum um acht Prozent gestiegen. Damit erzielten die deutschen Hersteller elektromedizinischer Geräte für 2020 einen Exportüberschuss von über sieben Milliarden Euro. Deutschland hat seine Rolle als einer der wichtigsten weltweiten Lieferanten für elektromedizinische Technik damit nach einem Jahr voller Schwierigkeiten bestätigt.
Folge 63: Über DVG, PDSG, DVPMG zum Datenraum Gesundheit

In den vergangenen beiden Jahren haben mehrere Gesetze die Digitalisierung im deutschen Gesundheitssystem in Bewegung gebracht. Nach Digitalen Gesundheitsanwendungen (DiGA), der elektronischen Patientenakte (ePA) soll nun das Digitale-Versorgung-und-Pflege-Modernisierungs-Gesetz (DVPMG) auch im Bereich der Pflege die Anwendung digitaler Lösungen unterstützen. Alle einzelnen Maßnahmen waren und sind richtig. Zu ausgewählten Punkten können bereits jetzt digitale Anwendungen eingesetzt werden.
Allerdings sind nur einzelne digitale Anwendung gesetzlich geregelt – punktuell und abgegrenzt. Vorhandene Daten für weitere digitale Anwendungen zu nutzen, ist nicht ohne weiteres möglich, denn es gibt keinen umfassenden Rechtsrahmen für die Nutzung von Daten im deutschen Gesundheitssystem. Dazu zählt auch, dass etwa die industrielle Forschung zum Beispiel weiterhin kein eigenes Antragsrecht besitzt, um Daten aus dem Forschungsdatenzentrum nach § 303d SGB V für die Forschung nutzen zu können.
Die bisherigen gesetzlichen Regelungen zur Digitalisierung des deutschen Gesundheitssystems müssen deshalb so schnell wie möglich zu einem Rechtsrahmen für einen Datenraum Gesundheit entwickelt werden. Das ist auch dahingehend von Bedeutung, dass Deutschland nur dadurch in umfassender Weise an dem zukünftigen European Health Data Space (EHDS) mitwirken kann. Denn Deutschland muss das Potenzial des EHDS zur Verbesserung der Gesundheitsversorgung und für die Forschung und Entwicklung im Leitmarkt Gesundheit nutzen.
Mehr dazu auch im Medtech Telegram Nr. 61.
Folge 62: Moderne Gesundheitsversorgung braucht zukunftsfähige Telematik-Infrastruktur

Die Telematik-Infrastruktur, kurz TI, ist die Plattform für sichere Kommunikation und Datenaustausch im deutschen Gesundheitssystem. Die TI ermöglicht jetzt die elektronische Patientenakte (ePA), das e-Rezept und die sichere Kommunikation zwischen Ärzten über den Dienst „KIM“. Das hohe Sicherheitsniveau der TI beruht dabei auf der starken Authentifizierung der Nutzer über physikalische Zugangspunkte: die Konnektoren. Diese technologische Basis ist sehr sicher, aber nicht mehr zeitgemäß.
Ursprünglich wurde die TI als Plattform für Ärzte, Krankenhäuser und Krankenkassen geplant, um die medizinische Versorgung der Patienten zu koordinieren. In den letzten Jahren ist deutlich geworden, dass dafür noch weitere Leistungserbringer, wie Apotheken, Pflegeeinrichtungen oder Heil- und Hilfsmittelerbringer, mit eigenen Diensten an die TI angebunden werden müssen, um das Konzept umfänglich nutzen zu können. Nun ist seit Beginn 2021 die ePA, die durch den Versicherten selbst verwaltet werden kann, über die TI ausgerollt worden. Damit stößt ihr ursprüngliches technisches Konzept endgültig an seine Grenzen. Die gematik, die für Konzeption und Betrieb der TI zuständig ist, hat deshalb jetzt ein Diskussionspapier mit Eckpunkten für die Weiterentwicklung der TI vorgelegt. Die TI 2.0 soll keine Abstriche bei der Sicherheit machen, aber die Nutzung für die immer größere Zahl verschiedener Anwender flexibler und komfortabler gestalten.
Die vergangenen Jahre haben gelehrt, dass die neuen Lösungen für die Anforderungen der Zukunft im Konsens vorbereitet und gemeinsam umgesetzt werden müssen. Deutschland braucht eine zukunftsfähige Telematik-Infrastruktur, mit deren Hilfe innovative, digitale Lösungen für eine moderne Gesundheitsversorgung umgesetzt werden können; und die auch die Verbindung zu Europa – genauer zum European Health Data Space – ermöglicht.
Die weitere erfolgreiche Digitalisierung des deutschen Gesundheitssystems hängt davon ab, dass alle Beteiligten gemeinsam mit der gematik die TI weiterentwickeln und zukunftsfest machen. Dann können Deutschland und Europa eine führende Rolle bei Smart Health einnehmen.
Folge 61: Konkrete deutsche Positionen zum EHDS jetzt vorbereiten

Die von der Europäischen Union finanzierte Joint Action „Towards the European Health Data Space“ (TEHDAS) hat begonnen. In den kommenden zwei Jahren sollen die Mitgliedstaaten der EU innerhalb des Arbeitsprogramms dieser Joint Action gemeinsam die Eckpunkte für den geplanten „European Health Data Space“ (EHDS) definieren. Konstruktive Mitarbeit ist nun gefragt – und dafür braucht es konkrete Positionen, um dieses zentrale europäische Projekt für die Nutzung von Gesundheitsdaten voranzutreiben. Deutschland sollte daher nun zügig seine eigenen Positionen vorbereiten.
Da in den Arbeitsgruppen der Joint Action nur die direkten Vertreter der Mitgliedstaaten mitwirken können, ist es dafür umso wichtiger, dass in Deutschland eine Diskussion zwischen den Vertretern in TEHDAS und den verschiedenen Teilen des Gesundheitssystems in Deutschland stattfindet. Insbesondere kommt es darauf an, die zukünftigen Eckpunkte für den EHDS mit der Weiterentwicklung der Telematik-Infrastruktur (TI) abzustimmen. Nur so können anschließend Dienste, die über die TI abgebildet werden, in Zukunft auch mit dem EHDS verbunden werden. Konkret betrifft das auch die „elektronische Patientenakte“ (ePA), die seit Beginn dieses Jahres auf freiwilliger Basis genutzt werden kann.
Folge 60: Nachholbedarf bei digitalen Versorgungsanwendungen in Deutschland

Die Regelungen zu den digitalen Gesundheitsanwendungen (DiGA) sind aus ZVEI-Sicht der richtige Schritt auf dem Weg hin zu einem digitalisierten Gesundheitssystem. Es stellt den Patienten ins Zentrum einer individualisierten Versorgung und verankert ihn mehr und mehr als Akteur in der Gesundheitsversorgung.
Aktuelle Zahlen von Eurostat zeigen jetzt aber auch den Nachholbedarf bei digitalen Versorgungsanwendungen (DiVA) komplexerer Art für die Regelversorgung. In Deutschland nutzen heute nur fünf Prozent der Bevölkerung smarte Gesundheitsgeräte. Dabei handelt es sich nach der Definition von Eurostat für diese Erhebung um Medizinprodukte, die vom Patienten selbst etwa zur Überwachung von Blutdruck, Blutzucker, Körpergewicht verwendet werden, und die durch eine Internetverbindung Messwerte an medizinisches Personal weiterleiten. Deutschland liegt damit genau auf dem Durchschnitt der EU-Mitgliedstaaten. In Island und Dänemark sind es 20 bzw. zwölf Prozent der Bevölkerung. Und auch in Österreich, Irland und Spanien liegt der Wert mit acht bzw. sieben Prozent höher als in Deutschland.
Um die digitale Gesundheitsversorgung in Deutschland zügig weiter auszubauen, müssen die Konzepte für die DiGA auf digitale Versorgungsanwendungen (DiVA) mit Medizinprodukten höherer Risikoklassen (IIb und III) ausgeweitet werden. Auch hier sollte der Nachweis von „positiven Versorgungseffekten“ für den Zugang zur Regelversorgung ausreichen. Unser MedTech-Telegram Nr. 39 zeigt am Beispiel von chronischer Herzinsuffizienz wie die Verbesserung der Versorgung auf diesem Wege erreicht werden kann – so kann das auch für andere Krankheitsbilder umgesetzt werden.
Folge 59: Remote-Audit für MDR möglich: Nationale Umsetzung jetzt

Die Corona-Pandemie schränkt weiterhin notwendige Überprüfungen von Medizinprodukten ein. Deshalb hat die Europäische Kommission am 11. Januar 2021 den Mitgliedsstaaten mit einer Bekanntmachung neue Möglichkeiten eingeräumt: Die im Rahmen der MDR notwendigen Audits der Hersteller durch die Benannten Stellen können unter bestimmten Bedingungen ohne persönliche Anwesenheit vor Ort der Prüfer stattfinden. Da die Bekanntmachung aber allein nicht als Voraussetzung für die sogenannten „Remote Audits“ in den einzelnen Mitgliedsstaaten ausreicht, müssen die „Zuständigen Behörden“ in Deutschland jetzt zügig nachziehen und diese schaffen. Erst dann dürfen die von Deutschland für die MDR notifizierten Benannten Stellen diese Möglichkeit anwenden.
Remote Audits sind nach Auffassung der Benannten Stellen und der Europäischen Kommission technisch möglich und geeignet, um das Ziel der Prüfung zu erreichen. Sie stellen in der derzeitigen Situation eine sinnvolle Maßnahme dar, um zu verhindern, dass mit Geltungsbeginn der MDR am 26. Mai 2021 wichtige Medizinprodukte nicht mehr verfügbar sind.
Die Zahl Benannter Stellen für die MDR – denen eine riesige Zahl notwendiger Prüfungen bis zum 26. Mai 2021 gegenübersteht – ist weiterhin zu gering. Die Prüfungstätigkeit dieser wenigen Stellen ist von den eingeführten Reise- und Kontaktbeschränkungen noch zusätzlich eingeschränkt. Ohne die nötige Prüfung können Hersteller ihre Medizinprodukte aber nicht in den EU-Mitgliedsstaaten in Verkehr bringen. Die Möglichkeit des Remote Audit aus der EU-Bekanntmachung ist dementsprechend dringend umzusetzen.
Folge 58: Erprobung von Innovationen – Weg zur breiten Anwendung immer noch zu lang

Damit eine medizinische Methode – sei es aus Diagnostik oder Therapie – ins Erstattungssystem der Gesetzlichen Krankenkassen (GKV) aufgenommen wird, muss vorher ein Nutzennachweis erbracht werden. Erst dann werden die Kosten von der GKV getragen.
Für die Medizintechnik gibt es dazu Hilfestellung von Politik und Selbstverwaltung: Der Gemeinsame Bundesausschuss (G-BA) kann über eine Erprobungsrichtlinie nach § 137 e SGB V die notwendige wissenschaftliche Studiendurchführung ermöglichen. Aktuelles Beispiel ist die europäische Ausschreibung zur „Amyloid-PET“, einer wegweisenden Methode zur Alzheimer-Diagnostik. Evidenzbasierte Medizin und nachhaltige Finanzierbarkeit sind die richtigen Prinzipien, auf denen das Sozialgesetzbuch V (SGB V) die Vorgaben für den Leistungskatalog der GKV formuliert. Im Sinne guter Patientenversorgung ist wissenschaftlich gesicherte Evidenz unbedingt notwendig.
Allerdings erfordert der Nutzennachweis ein umfassendes medizinisch-wissenschaftliches Know-How und einen enormen Zeitaufwand. Für eine Erzeugung dieser Evidenz fehlt für die Medizintechnikindustrie ein praktikables Instrumentarium. Die Organisation und der Aufwand zur Erfüllung der Anforderungen sind nicht für jede mögliche Verwendung von Medizintechnologien separat zu leisten. Bei einer Erprobung nach §137e SGB V dauert es bis zu fünf Jahren von der Beratung, über den Beschluss bis hin zur vollständigen Durchführung einer Studie. Eine schnelle, flächendeckende Anwendung neuer Technologien bei Patienten wird damit stark verzögert.
Das liegt auch daran, dass aktuell nur Evidenz zum rein medizinischen Nutzen akzeptiert wird. Andere Verbesserungen in der Gesundheitsversorgung spielen keine Rolle bei der Bewertung. Eine neue Methode zur Diagnostik, die schneller zu einer wirksamen Therapie führt, wird an den gleichen Kriterien gemessen wie eine völlig neue Methode zur Therapie dieser Erkrankung.
Für medizintechnische Innovationen muss deshalb ein Weg gefunden werden, der einerseits die Patientenversorgung optimal sichert und andererseits den Herstellern ein praktikableres Instrumentarium an die Hand gibt, um die geforderte Evidenz für die Erstattung zu erzeugen. Die Qualität und Wirksamkeit von Medizinprodukten sind durch die Anforderungen der CE-Kennzeichnung stets gewährleistet. In diesem Sinne trägt die neue Verfahrensordnung des G-BA zwar schon dazu bei, das Potenzial innovativer Medizinprodukte besser auszuschöpfen. Insgesamt dauert es aber noch zu lange, bis innovative Medizintechnik flächendeckend in der Versorgung genutzt werden kann.
MedTech-Telegram 2020
Folge 57: Corona-Pandemie: „Remote Audit“ für MDR ermöglichen, Versorgung sichern

Anfang April haben die Mitliedstaaten der EU mit einer gemeinsamen Entscheidung den Geltungsbeginn der MDR, der neuen EU-Verordnung über Medizinprodukte, um ein Jahr auf Mai 2021 verschoben. Diese Entscheidung war im Zuge der Corona-Krise sinnvoll, um wichtige Medizinprodukte in der EU verfügbar zu halten.
Mit dem Geltungsbeginn der MDR müssen alle Medizinprodukte, die in der EU in Verkehr gebracht werden, einer neuen Konformitätsbewertung nach der MDR unterzogen werden. Dafür ist in vielen Fällen die Beteiligung einer unabhängigen „Benannten Stelle“ notwendig. Bisher standen 58 dieser Benannten Stellen für die Medizinprodukte-Richtlinie der EU (MDD) zur Verfügung. Für die MDR sind Stand Dezember 2020 allerdings nur 17 „Benannte Stellen“ notifiziert worden. Selbst durch die Verschiebung des Geltungsbeginns der MDR auf Mai 2021 ist es bei dieser im Vergleich immer noch geringen Anzahl weiterhin unwahrscheinlich, dass alle notwendigen Audits für die neuen Konformitätsbewertungen bis zum Stichtag durchgeführt werden können. Hinzu kommen die Pandemie-bedingten Reisebeschränkungen: Die notwendigen Audits durchzuführen, die mit einer persönlichen Überprüfung bei den Herstellern einhergehen, wird dadurch zusätzlich deutlich erschwert.
In dieser Situation braucht es eine pragmatische Lösung: Die Europäische Kommission und die EU-Mitgliedstaaten schaffen die Möglichkeit für Prüfer und Hersteller, alle notwendigen Audits auch als „remote audits“, also ohne die persönliche Anwesenheit vor Ort, durchführen zu können. Sogenannte „Erst-Audits“ müssen eingeschlossen sein. Die persönlichen Kontrollen vor Ort sollten zu einem späteren Zeitpunkt nachgeholt werden müssen.
Mit „remote audits“ können mehr neue Medizinprodukte nach den Anforderungen der MDR trotz Reisebeschränkung und geringerer Kapazität von Benannten Stellen in Verkehr gebracht werden. Die Versorgung mit diesen Medizinprodukten kann so besser im kommenden Jahr gewährleistet werden – ohne, dass der Geltungsbeginn erneut verschoben werden muss.
Mehr Infos dazu gibt's auch in den MedTech-Telegrams 41 und 45. Mehr zu den Hintergründen in den Ausgaben 22, 36, 37, 38.
Folge 56: Gesetze zur Digitalisierung der Gesundheitswirtschaft mit einer Strategie koordinieren

Innerhalb von zwei Jahren hat das Bundesministerium für Gesundheit das vierte Gesetz zur Förderung der Digitalisierung der Gesundheitsversorgung angestoßen: Der Referentenentwurf zum Gesetz zur digitalen Modernisierung von Versorgung und Pflege (DVPMG) liegt nun vor.
Die bisherigen Gesetze zur Digitalisierung der deutschen Gesundheitswirtschaft haben die richtigen Maßnahmen eingeleitet, um die Gesundheitsversorgung mit digitalen Lösungen zu verbessern:
Digitale-Versorgung-Gesetz: Digitale Gesundheitsanwendungen (DiGA) sind jetzt Teil der Regelversorgung und können für Patienten und medizinisches Personal die Versorgung verstetigen.
Patientendaten-Schutz-Gesetz: Ab dem Jahr 2021 haben Versicherte der Gesetzlichen Krankenversicherung Anspruch auf eine elektronische Patientenakte. Relevante medizinische Informationen können dann jederzeit genutzt werden.
Krankenhauszukunftsgesetz: Mit der Finanzierung aus dem Krankenhaus-Zukunftsfonds kann die Infrastruktur von Krankenhäusern modernisiert und digitalisiert werden. Telemedizin und sektorübergreifende Versorgung können dann stärker genutzt werden.
Der Entwurf des DVPMG ergänzt viele dieser Maßnahmen oder führt sie weiter. All diese einzelnen Schritte sind notwendig für eine erfolgreiche digitale Transformation der Gesundheitsversorgung. Nun müssen sie in der Folge zusammengeführt und nicht mehr isoliert betrachtet werden. Sie müssen sich gegenseitig unterstützen, damit sie das Ziel einer individualisierten Gesundheitsversorgung erreichen. Das „Innovationsforum Digitale Gesundheit 2025“ des BMG hat gezeigt, wie ein solches Ergebnis erreicht werden kann. Die weiteren Gesetze zur Digitalisierung der Gesundheitsversorgung in Deutschland sollten sich daran orientieren.
Weitere grundlegende Gedanken des ZVEI dazu finden sich auch in den „20 Vorschlägen für eine erfolgreiche digitale Transformation der Gesundheitsversorgung“.
Folge 55: Krankenhaus-Zukunftsfonds: Modernisierung durch Vernetzung von Technik und Arbeitsabläufen anstreben

Im Krankenhauszukunftsgesetz (KHZG) werden zehn förderfähige Maßnahmen definiert, mit denen die deutschen Krankenhäuser modernisiert und die Digitalisierung der Gesundheitsversorgung in Deutschland gefördert werden sollen. Aus Mitteln des Bundes stehen dem Krankenhaus-Zukunftsfonds dafür drei Milliarden Euro zur Verfügung, die von den Ländern noch mit einem Eigenanteil von 30 Prozent für jede Maßnahme ergänzt werden. Bis 30. November 2020 soll das Bundesamt für Soziale Sicherung (BAS) über eine Förderrichtlinie festlegen, wie die Mittel aus dem Krankenhaus-Zukunftsfonds beantragt und verwendet werden können.
Um damit tatsächlich einen Schub für eine bundesweite Digitalisierung und Modernisierung der Krankenhausstruktur erreichen zu können, müssen sich Bund und Länder dringend auf ein gemeinsames Ziel mit messbaren Ergebnissen für die Verbesserung der Gesundheitsversorgung verständigen. Deshalb sollten die förderfähigen Maßnahmen daran gemessen werden, wie umfassend sie die medizintechnische Infrastruktur im Krankenhaus mit den dortigen IT-Systemen und Arbeitsabläufen vernetzen. Medizinische Daten müssen direkt elektronisch zwischen medizintechnischen Geräten und IT-Systemen ausgetauscht werden, damit eine Steuerung und Beobachtung von Arbeitsabläufen in der Gesundheitsversorgung möglich werden. Dafür ist ein Dialog zwischen Anwendern und Anbietern während der Planung notwendig.
Eine erfolgreiche Modernisierung und Digitalisierung der deutschen Krankenhäuser muss diese verschiedenen Ebenen interoperabel miteinander vernetzen. Dieses Ziel sollte die Förderrichtlinie vorgeben oder unterstützen.
Folge 54: Digitalisierung der Gesundheitswirtschaft braucht verlässlichen Rechtsrahmen – EU2020DE

Die Politik sollte nun ihr Augenmerk besonders darauf richten, auf europäischer Ebene einen verlässlichen Rechtsrahmen zu schaffen, der Unternehmen und Wissenschaft zu Investitionen und Entwicklungsarbeit für Künstliche Intelligenz (KI) im Gesundheitsbereich ermutigt. Dieses Fazit zog Bundesgesundheitsminister Jens Spahn zum Abschluss der High Level-Konferenz „Digital Health 2020" am 11. November 2020.
Dass das große Potenzial von KI im Interesse der medizinischen Versorgung genutzt werden muss und dass dieser Nutzen nur in der Kombination von KI und menschlichen Anwendern entsteht, ist ein weiteres Ergebnis der Konferenz. Einigkeit herrschte ebenfalls dabei, dass Vertrauen in die Qualität und Sicherheit der KI-Anwendungen eine unersetzliche Voraussetzung ist und dass, um KI-Anwendungen in Europa selbst entwickeln zu können, es deshalb einen Zugang zu qualitativ hochwertigen Gesundheitsdaten braucht. Der geplante „European Health Data Space" müsse deshalb verlässliche Möglichkeiten zur Nutzung von Gesundheitsdaten sicherstellen.
Diese Punkte, für die sich der ZVEI bereits im MedTech-Telegram Nr. 47 zu Beginn der deutschen EU-Ratspräsidentschaft ausgesprochen hat, wurden von den Teilnehmern der Konferenz bestätigt. Zusätzlich unterstützen die Vorschläge für eine „European Health Union“, die am Tag der Konferenz veröffentlicht wurden, die ZVEI-Forderung nach einem strukturierten Austausch der EU-Mitgliedstaaten zu Gesundheitsthemen. Die deutsche EU-Ratspräsidentschaft hat damit für den Bereich Gesundheit ein wichtiges Ergebnis erreicht.
Folge 53: Prognose Weltmarkt Elektromedizin 2021 – Silberstreif am Horizont

Die globalen konjunkturellen Folgen der Corona-Pandemie beeinflussen auch die Hersteller von elektromedizinischer Technik. Die weltweite Nachfrage wird im Jahr 2020 gegenüber dem Vorjahr insgesamt zurückgehen. Allerdings ist die Entwicklung in verschiedenen Teilen der Welt sehr unterschiedlich.
Im vergangenen Jahr erhöhte sich das globale Marktvolumen für elektromedizinische Technik noch um fünf Prozent. Industrie- und Schwellenländer wuchsen mit vier bzw. sechs Prozent ähnlich dynamisch. In diesem Jahr fallen die regionalen Entwicklungen unterschiedlicher aus: Die Nachfrage in den Industrieländern wird voraussichtlich um vier Prozent sinken, in den Schwellenländern stagnieren. Letztere machen etwa ein Drittel des Weltmarktes für elektromedizinische Technik aus. Für den Weltmarkt bedeutet das insgesamt einen Rückgang von drei Prozent.
Erholung ist aber bereits im kommenden Jahr möglich – mit Aussichten auf einen Anstieg der weltweiten Nachfrage in der Größenordnung von acht Prozent. In den Schwellenländern und den Ländern Asiens könnte die einsetzende Erholung sogar bei etwa neun Prozent liegen. Über die Jahre betrachtet, würde die Nachfrage dann wieder dem langjährigen Trend folgen.
Mehr als 80 Prozent der in Deutschland hergestellten Elektromedizingüter werden im Auslandsgeschäft umgesetzt, entsprechend hoch ist die Bedeutung des Weltmarkts für die deutschen Hersteller. Sie ist die Basis für Wachstum und Beschäftigung, aber auch für Innovationskraft und Wettbewerbsfähigkeit. Und auch für die Gesundheitsversorgung in Deutschland und Europa ist diese Entwicklung wichtig: Sie stellt sicher, dass wichtige Medizinprodukte auch in Zukunft in Deutschland und Europa entwickelt und produziert werden können. Die letzten Monate haben gezeigt, wie wichtig das ist.
Folge 52: Meilenstein auf dem Weg zu digitaler Versorgung: erste DiGA sind verfügbar

Auf dem Weg zur digitalen Gesundheitsversorgung ist nun ein weiterer Meilenstein erreicht: Die „App auf Rezept“ ist nun tatsächlich verfügbar. Das Bundesamt für Arzneimittel und Medizinprodukte (BfArM) hat kürzlich sein Verzeichnis für digitale Gesundheitsanwendungen (DiGA) veröffentlicht. Erste DiGA sind auch bereits im Verzeichnis gelistet. Sie erfüllen die entsprechenden gesetzlichen Vorgaben (Apps oder browserbasierte Anwendungen, die als Medizinprodukt niedriger Risikoklasse CE-gekennzeichnet sind) für DiGA, sind geprüft und können nun bei entsprechender Diagnose von Ärzten und Psychotherapeuten verschrieben und direkt von den gesetzlichen Krankenkassen erstattet werden.
Sowohl das Tempo der getroffenen gesetzlichen Regelungen als auch die bisherige Umsetzung durch das BfArM sind aus ZVEI-Sicht der richtige Schritt auf dem Weg hin zu einem digitalisierten Gesundheitssystem, das den Patienten ins Zentrum einer individualisierten Versorgung stellt und ihn auch als Akteur verankert.
Der nächste Schritt muss nun die Ausweitung dieser Regelung auf höhere Risikoklassen beinhalten (IIb und III), um auch digitale Gesundheitsanwendungen komplexerer Art für die Regelversorgung zuzulassen. Dazu sollte eine Hilfestellung beim Nachweis der „positiven Versorgungseffekte“ gegeben werden, z. B. bei vergleichenden Studien.
Folge 51: Höherer Etat für BMG in 2021 – Strategie für Gesundheitswirtschaft anschließen

Der Haushaltsetat 2021 des Bundesministeriums für Gesundheit (BMG) steht fest: Er wird um knapp 10 Milliarden Euro aufgestockt (15,35 Mrd. in 2020, 24,29 Mrd. in 2021). Diese Mittel sollte jetzt auch genutzt werden, um eine Strategie für die Gestaltung der Gesundheitswirtschaft in Deutschland ab 2021 umzusetzen.
Zwar entfällt der größte Anteil in Höhe von 14,5 Milliarden Euro weiterhin auf den Zuschuss an den Gesundheitsfonds zur pauschalen Abgeltung der Aufwendungen der gesetzlichen Krankenkassen für gesamtgesellschaftliche Aufgaben. Es stehen aber auch neue Mittel für wichtige Bereiche in der Gesundheitsversorgung zur Verfügung:
Fünf Milliarden Euro gehen an Gesundheitsfonds für durch die Sars-CoV-2-Pandemie verursachten Belastungen des Gesundheitssystems.
Neu im Etat vorgesehen sind die drei Milliarden Euro als „Zuweisungen an die Liquiditätsreserve des Gesundheitsfonds für das Zukunftsprogramm Krankenhäuser“.
Forschungsförderungen für
die Erschließung des Potenzials digitaler Anwendungen in der Gesundheitsversorgung (5 Mio. Euro).
Maßnahmen zur Förderung Künstlicher Intelligenz im Gesundheitswesen (16 Mio. Euro).
den Aufbau und Betrieb eines Datenkompetenzzentrums Gesundheitsversorgung (2 Mio. Euro).
Knapp 140 Millionen Euro stellt das BMG für die finanzielle Unterstützung internationaler Organisationen sowie für Kosten der internationalen Zusammenarbeit auf dem Gebiet des Gesundheitswesens. Hiervon sind 26,7 Millionen Euro für den Mitgliedsbeitrag an die Weltgesundheitsorganisation (WHO) vorgesehen.
Es ist ein wichtiges und das richtige Signal, dass in 2021 deutlich mehr Budget für das Gesundheitsressort bereitgestellt wird als noch 2020. Mit den geplanten Investitions- und Förderbereichen kann das deutsche Gesundheitssystem weitere Schritte auf dem Weg zur bestmöglichen, digitalisierten und individualisierten Gesundheitsversorgung machen.
Es ist wichtig, diese verschiedenen Ansätze jetzt in eine Strategie für die Gesundheitswirtschaft in Deutschland für das Jahr 2021 und darüber hinaus einzubetten.
Folge 50: Zukunftsbranche Medizintechnik – Rückblick und Ausblick

Im April 2018 hat der ZVEI das erste MedTech-Telegram veröffentlicht, um den wirtschaftlichen und gesellschaftlichen Stellenwert der Gesundheitswirtschaft und der Medizintechnik deutlich zu machen. Ausgabe 50 des MedTech-Telegram ist Gelegenheit für eine kleine Bestandsaufnahme. Die bisherigen 49 Ausgaben des MedTech-Telegram belegen, wie stark die Branche Medizintechnik nicht nur von technischen Entwicklungen, sondern auch von politischen Entscheidungen und gesellschaftlichen Positionen beeinflusst wird.
Aktuell eröffnen Digitalisierung und Vernetzung völlig neue Methoden und Verfahren in der medizinischen Versorgung. Eine individualisierte Gesundheitsversorgung, die – im Gegensatz zur heutigen Situation im deutschen Gesundheitssystem – sektorenübergreifend, kontinuierlich, flexibel und vernetzt sowie zunehmend präventiv ist, wird möglich.
Dass die Gesundheitswirtschaft bereits heute einer der größten Bereiche der deutschen Volkswirtschaft ist, ist inzwischen gut dokumentiert, zum Beispiel durch die regelmäßige „Gesundheitswirtschaftliche Gesamtrechnung“ des Bundeswirtschaftsministeriums. Zugleich gilt aber auch, dass die Medizintechnik in Deutschland und Europa durch die neue EU-Verordnung über Medizinprodukte, die Digitalisierung und die Diskussion über die Nutzung von Daten vor großen Herausforderungen steht.
Die deutsche Medizintechnik ist im Mittelstand verankert und international enorm wettbewerbsfähig. Deutschland braucht deshalb eine Strategie für die industrielle Gesundheitswirtschaft, damit diese Zukunftsbranche auch weiterhin am Standort Deutschland wirtschaftlich erfolgreich ist und Innovationen für die Gesundheitsversorgung in Deutschland und Europa entwickelt und produziert werden.
Folge 49: Mit Digitalisierung Gesundheitsversorgung neu denken

In den letzten beiden Jahren ist bei der Digitalisierung der Gesundheitswirtschaft in Deutschland viel auf den Weg gebracht worden:
- Versicherte der Gesetzlichen Krankenversicherungen haben Anspruch auf „Digitale Gesundheitsanwendungen“ mit denen die Gesundheitsversorgung kontinuierlich und näher beim Patienten stattfinden kann.
- Die Versicherten werden bald relevante medizinische Informationen in einer „elektronischen Patientenakte“ (ePA) sammeln und im Rahmen der medizinischen Versorgung anderen Ärzten zur Verfügung stellen können. Gerade für Patienten mit chronischen Erkrankungen ein wichtiger Fortschritt. Außerdem können die Versicherten Inhalte der ePA freiwillig für die medizinische Forschung freigeben, wenn sie möchten.
- Mit dem „Zukunftsprogramm Krankenhäuser“ sollen jetzt fast vier Milliarden Euro zusätzlich für Investitionen in die Digitalisierung der Krankenhäuser in Deutschland zur Verfügung gestellt werden.
Mit diesen Maßnahmen kann das deutsche Gesundheitssystem auf die demografische Entwicklung und zukünftige Ausnahmesituationen, wie eine Pandemie, die richtigen Antworten finden. Allerdings müssen dafür die bis jetzt für sich stehenden Maßnahmen miteinander verbunden werden. Das Bundesministerium für Gesundheit hat dafür den Anstoß mit dem „Innovationsforum Digitale Gesundheit 2025“ gegeben. Wir müssen die Gesundheitsversorgung in Deutschland und Europa mit diesen und weiteren Möglichkeiten der Digitalisierung in den nächsten Jahren neu denken. Die Gesundheitsversorgung des 21. Jahrhunderts entsteht durch die digitale Transformation der Gesundheitsversorgung von heute. Grundlegende Gedanken des ZVEI dazu finden sich im „Grünbuch Digitalisierung der Gesundheitswirtschaft“ und den „20 Vorschlägen für eine erfolgreiche digitale Transformation der Gesundheitsversorgung“.
Folge 48: Messbare Ziele und konkrete Investitionen im Zukunftsprogramm Krankenhäuser verankern

Als Teil des Konjunkturpakets zur Bekämpfung der Folgen der Corona-Pandemie stellt die Bundesregierung drei Milliarden Euro für Investitionen zur Verbesserung der Krankenhausstruktur und der Digitalisierung in deutschen Krankenhäusern zur Verfügung. Die Bundesländer wollen diese Mittel um weitere 30 Prozent, also 900 Millionen Euro erhöhen.
Digitalisierung ist ein Zusammenspiel vieler verschiedener Komponenten. Daher gehören zu den förderfähigen Kosten neben der Implementierung von IT-Systemen und der notwendigen Hardware auch weitere technische Ausrüstungen, u. a. auch aus der Medizintechnik – allerdings werden eben diese im Zukunftsprogramm noch nicht ausreichend mitgedacht. Gerade beim Ziel der digitalen Leistungsanforderung und Rückmeldung werden Investitionen in medizintechnische Geräte notwendig sein, die mit den entsprechenden IT-Systemen interagieren können.
Unabhängig davon steht der Summe an Investitionsmitteln, 3,9 Milliarden Euro, allerdings eine kumulierte Investitionslücke von 30 Milliarden Euro (laut der Deutschen Krankenhaus Gesellschaft DKG) gegenüber.
Zuständig für die Finanzierung von Investitionen im Krankenhaus sind die Bundesländer, die über ganz Deutschland betrachtet in den letzten Jahren in Summe weniger Mittel zur Verfügung gestellt haben, als insgesamt von den Krankenhäusern angemeldet wurden.
Um mit den jetzt zusätzlich zur Verfügung stehenden Mittel tatsächlich einen zusätzlichen Schub für eine bundesweite Digitalisierung und Verbesserung der Krankenhausstruktur erreichen zu können, müssen sich Bund und Länder dringend auf ein gemeinsames Programm mit messbaren Zielen für die Digitalisierung verständigen. Sonst besteht die Gefahr, dass die zusätzlichen Investitionsmittel den Investitionsstau mildern, ohne nachhaltig zur Digitalisierung der Krankenhäuser beizutragen. Diese Ziele sollten über einen Dialog mit Anwendern und Industrie definiert werden, damit nachhaltige Lösungen für den Bedarf in der Versorgung auf Basis vorhandener Angebote schnell in die Praxis umgesetzt werden können.
Folge 47: EU-Ratspräsidentschaft: Gesundheitsversorgung und Gesundheitswirtschaft in Europa stärken

Am 1. Juli übernimmt Deutschland die EU-Ratspräsidentschaft. Die Covid-19-Krise hat gezeigt, wie wichtig leistungsfähige Gesundheitssysteme und schnelle Innovation auch in der modernen Welt sind. Medizintechnik und industrielle Gesundheitswirtschaft sind essenzielle Voraussetzung hierfür. Deutschland sollte die EU-Ratspräsidentschaft deshalb nutzen, um Europas Innovationskraft im Gesundheitsbereich zu stärken. Der European Health Data Space (EHDS) legt dafür eine unverzichtbare Grundlage. Mit dieser Basis können Deutschland und Europa bei Smart Health eine internationale Führungsrolle erreichen (siehe Medtech-Telegram, Folge 46). Gleiches gilt für den Kampf gegen den Krebs: Mit dem flächendeckenden Einsatz moderner Medizintechnik, z. B. für ein Lungenkrebsscreening, kann Europa hier zum Vorreiter werden.
Dafür braucht es in Europa einen ständigen Austausch der Mitgliedsstaaten untereinander und mehr Handeln nach gemeinsamen Vorstellungen bei der Modernisierung der Gesundheitsversorgung in den Mitgliedstaaten. Die deutsche Ratspräsidentschaft sollte hierfür das Fundament legen. In die Zeit der deutschen Präsidentschaft fällt auch die Aufgabe, die Vorbereitungen und nötigen Entscheidungen für den Geltungsbeginn von MDR (Medical Device Regulation) und IVDR (In-vitro Diagnostic Regulation) weiter voranzutreiben. Pragmatische Ansätze und Lösungen sind gefragt, um die für eine moderne Gesundheitsversorgung notwendigen innovativen Produkte schnell in der gesamten EU verfügbar zu machen – und um die industrielle Gesundheitswirtschaft und Forschung und Entwicklung in Europa so nachhaltig zu stärken.
Folge 46: European Health Data Space: Basis und Chance für Smart Health aus Deutschland und Europa

Europa hat das Potenzial eine führende Rolle bei Smart Health einzunehmen. Nur mit einem European Health Data Space (EHDS) für alle Gesundheitsdaten hat Europa auch die Chance, dieses Potenzial erfolgreich zu nutzen. Denn verlässliche Daten in guter Qualität und großer Menge sind Voraussetzung dafür, dass in Deutschland und in ganz Europa Smart Health-Anwendungen entwickelt werden und die Gesundheitswirtschaft erfolgreich digital transformiert werden kann. So können wir die Gesundheitsversorgung für jeden Bürger besser machen und neue Möglichkeiten für Diagnose und Therapie entwickeln. Dafür brauchen wir eine Kultur des Data Sharing auf nationaler und europäischer Ebene, damit Forschung und Entwicklung auch bei seltenen oder neuen Erkrankungen – wie aktuell auch bei Covid-19 – auf möglichst viele Daten zur Diagnose- und Therapieentwicklung zugreifen kann. Der EHDS muss dazu zügig die technischen Voraussetzungen schaffen und mit innovationsfreundlichen rechtlichen Rahmenbedingungen begleiten. Die „1+ Million Genomes“-Initiative der EU zeigt wie komplex es ist, eine gemeinsame Datennutzung über die Grenzen der EU-Mitgliedstaaten zu organisieren. Im Rahmen der deutschen EU-Ratspräsidentschaft wird der geplante European Health Data Space (EHDS) daher zu Recht eine wichtige Rolle spielen.
Folge 45: MDR-Geltungsbeginn verschoben – was folgt nun?

Eigentlich wäre heute, am 26. Mai 2020, der Geltungsbeginn der Medical Device Regulation (MDR) gewesen. Die Mitgliedstaaten der EU und das Europäische Parlament haben im April 2020 allerdings beschlossen, den Geltungsbeginn der MDR auf den 26. Mai 2021 zu verschieben.
Aber was bedeutet das nun für die Hersteller – ist somit alles “geregelt”?
Grundsätzlich ist die Verschiebung der MDR ein richtiger und wichtiger Schritt für Hersteller von Medizinprodukten und die Gesundheitsversorgung in Deutschland und Europa. Bereits bestehende Engpässe werden nun nicht noch weiter verschärft.
Auch wenn grundsätzlich die Rechtslage in Europa für die nächsten zwölf Monate geklärt ist, entsteht in Deutschland und den anderen Mitgliedstaaten jetzt dennoch eine komplizierte rechtliche Situation:
Die Medical Device Regulation (MDR) ist bereits seit 2017 in Kraft, der Gültigkeitsbeginn wurde aber nun auf den 26. Mai 2021 verschoben. Neue Medizinprodukte können dennoch bereits heute einer Konformitätsbewertung nach MDR unterzogen werden.
Die Medical Device Directive (MDD) bleibt nun für weitere zwölf Monate gültig. Medizinprodukte können weiterhin einer Konformitätsbewertung nach MDD unterzogen und in Verkehr gebracht werden. Da sich viele Benannte Stellen im MDR-Notifizierungsprozess befinden, könnten Neu-Bewertungen nach MDD allerdings aus Kapazitätsgründen nicht mehr möglich sein.
Das Medizinproduktegesetz (MPG) wandelt die MDD in deutsches Recht um. Es sollte zum 26. Mai 2020 außer Kraft gesetzt werden. Durch die Verschiebung bleibt es aber nun zwölf weitere Monate gültig und wird weiter den rechtlichen Rahmen für das Inverkehrbringen von Medizinprodukten bilden. Das gibt Herstellern eine gewisse Planungssicherheit.
Das Medizinprodukteanpassungsgesetz (MPEUAnpG) war bereits beschlossen, wurde aber noch nicht im Bundesgesetzblatt veröffentlicht und ist somit noch nicht offiziell gültig. Die MDR ist zwar durch ihren Status als EU-Verordnung direkt in den Mitgliedsstaaten gültig, allerdings braucht es in Deutschland eine Anpassung des Medizinprodukterechts an die MDR. So wird das MPEUAnpG z. B. das MPG außer Kraft setzen. Durch die Verschiebung muss es nun aber auch geändert werden, weil zahlreiche Regelungen jetzt erst zu einem späteren Zeitpunkt in Kraft treten können.
Das Medizinprodukterecht-Durchführungsgesetz (MPDG) wurde im Rahmen des MPEUAnpG beschlossen. Mit dem Gesetz werden die Vorschriften des Medizinprodukterechts in Deutschland an die Anforderungen der MDR im Detail angepasst.
Zweites Gesetz zum Schutz der Bevölkerung bei einer epidemischen Lage von nationaler Tragweite: Aus zeitlichen und organisatorischen Gründen erfolgen die Änderungen des MPEUAnpG durch eine Regelung in diesem Gesetz.
Gewonnene Zeit nutzen, Vorbereitungen sorgfältig abschließen
Worauf es nun ankommt, ist, die gewonnene Zeit zu nutzen, um für den Geltungsbeginn der MDR im Mai 2021 bereit zu sein. Das bedeutet: Die zügige Notifizierung einer ausreichenden Zahl Benannter Stellen für die MDR und europaweit gültige, grundsätzliche Leitlinien für die parallele Anwendung von MDD und MDR in den Mitgliedstaaten der EU. Diese Leitlinien sollten auf europäischer Ebene vereinbart werden, damit in allen Mitgliedstaaten gleiche Bedingungen herrschen. Für die Hersteller von Medizinprodukten ist dies wichtig, um Sicherheit für den Export in andere EU-Länder zu haben.
Folge 44: Gesundheitswirtschaft als Stabilisator der Gesamtwirtschaft – Deutschland braucht Strategie für die industrielle GW

Sichere Versorgung, Wachstum und Beschäftigung
Die Gesundheitswirtschaft (GW) leistet mit einem Anteil von zwölf Prozent am Bruttoinlandsprodukt (BIP) und einer gesamtdeutschen Exportquote von acht Prozent weiterhin einen bedeutenden Beitrag zur Wirtschaftskraft in Deutschland. Die hohe Bruttowertschöpfung (372 Milliarden Euro) und der beständige Wachstumskurs macht die Branche zu einem Stabilisator und Wachstumstreiber der gesamtwirtschaftlichen Entwicklung. Das belegen auch die aktuellen Daten der im Auftrag des Bundesministeriums für Wirtschaft und Energie erstellten Gesundheitswirtschaftlichen Gesamtrechnung.
Mit 22 Prozent der Bruttowertschöpfung der gesamten Gesundheitswirtschaft (81 Milliarden Euro) ist die industrielle Gesundheitswirtschaft (iGW) eine der größten und bedeutendsten Teilbranchen der GW in Deutschland. Dank ihrer Innovationskraft erzielt sie trotz starkem internationalen Wettbewerb Exporterlöse in Höhe von 119 Milliarden Euro (90 Prozent der Exporterlöse der gesamten GW). Innerhalb der industriellen Gesundheitswirtschaft leistet die Medizintechnik mit einer Bruttowertschöpfung von 15 Milliarden Euro (18,5 Prozent der iGW, vier Prozent der GW) konstant einen wichtigen Beitrag zum Wachstum der gesamten Gesundheitswirtschaft. Das zeigt sich auch in der seit 2010 kontinuierlich steigenden Exportquote, die 25 Prozent (30 Milliarden Euro) der deutschen Gesundheitswirtschaft ausmacht. Die MedTech-Branche ist damit auch ein wesentlicher Bestandteil der Wertschöpfungskette Gesundheit.
Positive Beiträge zur gesamtwirtschaftlichen Entwicklung jetzt sichern
Deutschland braucht jetzt eine Strategie für die industrielle Gesundheitswirtschaft, damit die gute Position von heute nicht verloren geht. Die Erfahrungen in der Corona-Pandemie haben zum einen gezeigt, wie wichtig es für eine funktionierende und leistungsfähige Gesundheitsversorgung ist, dass Medizinprodukte und Arzneimittel auch in Deutschland und Europa produziert werden. Forschung und Entwicklung (F+E) in Deutschland und Europa anzusiedeln ist dafür eine wesentliche Voraussetzung. Zum anderen hat diese Krise die Bedeutung der Digitalisierung auch in der Gesundheitsversorgung verdeutlicht. Produkte und Lösungen für eine digitalisierte Gesundheitsversorgung können in Deutschland und Europa aber nur entwickelt werden, wenn auch die F+E der iGW Zugang zu Gesundheitsdaten ohne Personenbezug hat – und das auch auf EU-Ebene. Deutschland muss deshalb in der bald beginnenden EU-Ratspräsidentschaft den Aufbau des European Health Data Space (EHDS) vorantreiben, in dem dann auch deutsche Gesundheitsdaten verfügbar sein sollten. Weitere Unterstützung – und stärker als bisher – benötigt die Branche am Standort Deutschland auch für das Bestehen im internationalen Wettbewerb. Mit Blick auf den verschobenen Geltungsbeginn (um ein Jahr auf den 26. Mai 2021) der neuen EU-Verordnung über Medizinprodukte (MDR), muss diese Zeit genutzt werden, um praxisorientierte Lösungen für die Anwendung vieler bürokratischer Anforderungen der MDR an Bestandsprodukte zu finden.
Mit einer umfassenden Strategie kann auch der positive Beitrag, den die GW im Allgemeinen und die iGW im Besonderen zur Beschäftigung in Deutschland liefert, weiter ausgebaut werden:
Gesundheitswirtschaft als Garant für langfristige Arbeitsplätze
Die Zahl der Arbeitsplätze in der Gesundheitswirtschaft bleibt stabil: Mit 7,5 Millionen Beschäftigten und einem Anteil von 17 Prozent am gesamten deutschen Arbeitsmarkt ist jeder sechste Arbeitsplatz in der Gesundheitswirtschaft angesiedelt. Innerhalb dieser ist jeder siebte Beschäftigte in der industriellen Gesundheitswirtschaft (iGW) tätig. Das entspricht einem Anteil von 14 Prozent an der gesamten Gesundheitswirtschaft und etwas über einer Million Erwerbstätiger in absoluten Zahlen.
In der MedTech-Branche bleibt die Anzahl der Erwerbstätigen ebenfalls stabil: 200.000 Beschäftigte sind hier tätig. Damit liegt der Anteil an den Erwerbstätigen der iGW bei 20 Prozent und der gesamten Gesundheitswirtschaft bei drei Prozent, was die Branche zu einem sehr wichtigen Bestandteil der Gesundheitswirtschaft macht.
Folge 43: Erkenntnisse aus Corona-Krise unbedingt für weitere Digitalisierung nutzen

Die „Corona-Krise“ stellt das deutsche Gesundheitssystem vor besondere Herausforderungen. Mehr denn je werden Schwachstellen in Abläufen, aber insbesondere auch die Potenziale der Digitalisierung begreiflich. Digitalisierte Prozesse nehmen eine Schlüsselrolle für den optimalen Schutz von Leben und Gesundheit ein – das ist auch die neueste Bilanz des Sachverständigenrats zur Begutachtung der Entwicklung im Gesundheitswesen.
Der Coronavirus hat die gesamte Welt in eine Krise gestürzt und seine Ausbreitung muss schnellstmöglich eingedämmt werden. In ihrer Bedrohung für einzelne Menschen, wirkt die Pandemie auch als eine Art Katalysator für die Digitalisierung und die damit einhergehende Akzeptanz und Aufklärung der Bevölkerung. Nach nur 10 Tagen „live“, wurden bereits über 400.000 freiwillige, pseudonymisierte gespendete Datensätze für die Corona-Datenspende-App des RKI verzeichnet. Und mit dem elektronischen DIVI-Intensivregister können in Deutschland freie Intensivbetten in kürzester Zeit identifiziert werden. Das zeigt: Deutschland kann Digitalisierung – auch mutig und schnell. Nur müssen Sinn und Zweck eindeutig sein und der Nutzen eindeutig erkennbar sein.
Das Umsetzungsbild „Digitale Gesundheit 2025“ des Bundesministeriums für Gesundheit weist einen guten Weg. An den jetzigen digitalen Erfolgen muss durch das Vorantreiben digitaler Projekte, die noch in der Testphase sind angeknüpft werden– wie das Deutsche Elektronische Melde- und Informationssystem für den Infektionsschutz (DEMIS). Ziel muss der schnelle Eintritt in die Regelversorgung sein. Denn zu den Schwachstellen, die durch die Pandemie sichtbar wurden, gehört, dass das Robert-Koch-Institut Infektionsdaten noch immer per Fax erhält.
Die elektronische Patientenakte (ePA) ab 2021 wird die Grundlage für die noch weitergehende Verbesserung der Versorgung durch Digitalisierung bilden. Sie bietet das Potenzial, um heute und auch in Zukunft, die bestmögliche Gesundheitsversorgung zu gewährleisten. Mit der ePA besteht u. a. die Möglichkeit, Menschen aus Risikogruppen wesentlich zielgenauer und schneller zu identifizieren und informieren – was sich unbedingt nicht auf Covid-19 beschränken sollte.
Jetzt ist die Zeit zum Anpacken. Jetzt ist die Zeit, die digitale und vernetzte Gesundheitsversorgung voranzutreiben, um durch optimale Datennutzung eine optimale Patientenversorgung anzustreben. Mehr dazu auch in unseren 20 Vorschlägen für eine digitale Transformation.
Folge 42: „Datenspende“ muss auch der Industrieforschung nutzen

Das neue Patientendaten-Schutzgesetz (PDSG) regelt in vielen Details den Schutz von Patientendaten und den Umgang der Daten in der elektronischen Patientenakte (ePA). Versicherte bekommen künftig aber auch die Möglichkeit, ihre Daten aus der ePA der medizinischen Forschung freiwillig zur Verfügung zu stellen.
Dass Daten für die medizinische Forschung gespendet werden können, ist ein wichtiger Schritt nach vorn. Das Gesetz übersieht dabei aber einen wichtigen Bereich der Forschung in der Gesundheitswirtschaft: Das freiwillige Teilen der eigenen Gesundheitsdaten zur medizinischen Forschung schließt die Forschung durch die Industrie nicht ein.
Stand heute ist die Medizintechnikindustrie nach der digitalen Kommunikation das Technologiefeld mit der zweitgrößten Anzahl an Patentanmeldungen beim europäischen Patentamt. Für die Entwicklung neuer datenbasierter Medizinprodukte und medizinischer Anwendungen muss die Industrie aber ebenfalls auf entsprechende Datenbestände zugreifen können. Die Entwicklung von Produkten ist dabei mit der wissenschaftlichen Grundlagenforschung nicht zu vergleichen. Denn bevor ein Ergebnis der wissenschaftlichen Grundlagenforschung als Medizinprodukt in Verkehr gebracht werden kann, sind weitere Entwicklungsarbeiten notwendig.
Dafür brauchen Hersteller von Medizinprodukten und andere Unternehmen der industriellen Gesundheitswirtschaft ein eigenes Recht zur Datennutzung gegenüber dem Forschungsdatenzentrum, das die Datenspenden abwickelt. Nicht nur zu Entwicklungszwecken, die über die Erkenntnisgewinnung aus der wissenschaftlichen Grundlagenforschung hinausgeht, sondern auch um die Qualität und Sicherheit der entwickelten Produkte zu prüfen und gegenüber der Marktüberwachung zu belegen.
Folge 41: Coronavirus und MDR: Doppelbelastung für die Medizintechnik-Branche

Der Geltungsbeginn der Medical Device Regulation (MDR) am 26. Mai 2020 rückt näher. Medizintechnikhersteller bereiten sich seit dem Inkrafttreten 2017 auf diese Stichtag vor. Die Probleme bei der Umsetzung sind während der letzten Jahre viel diskutiert worden: Die (zeitweise) fehlenden Rechtsakte und Leitfäden – und ganz akut: die fehlende Zahl Benannter Stellen.
Die Ausbreitung des Coronavirus trifft die Medizintechnikbranche somit nun in einer besonders kritischen Phase. Dabei sollte vor allem jetzt ein reibungsloser Ablauf bei Zulassungen und Qualitätsprüfungen gewährleistet sein – denn im Zweifel kann der Einsatz von Medizintechnik bei COVID-19-Patienten lebensrettend sein.
Aber: Die ersten Benannten Stellen und wichtigen Behörden schließen bereits oder sind in ihrer Tätigkeit durch die Quarantänebestimmungen eingeschränkt. Geplante Audits können zudem aufgrund neuer Reisebeschränkungen nicht vor Ort durchgeführt werden. Ebenso haben Hersteller mit diesen und weiteren Einschränkungen zu kämpfen: Die Produktion von Geräten ist in Gefahr, wenn Produktionsstätten nun geschlossen werden oder Lieferketten unterbrochen sind.
Mit Blick auf den 26. Mai ist eine Aussetzung des Geltungsbeginns der MDR auf europäischer Ebene unter diesen Umständen zwingend notwendig: Das MDR Corrigendum von Dezember 2019 stellt zwar sicher, dass Bestandsprodukte mit über den Stichtag hinaus gültigen Zertifikaten nach der bisher geltenden Medizinprodukte-Richtlinie (MDD) weiterhin in Verkehr gebracht werden können. Bestandsprodukte, deren MDD-Zertifikat nicht mehr gültig ist, dürfen dagegen ohne Bewertung nach MDR nicht mehr in Verkehr gebracht werden. Gleiches gilt für neue, innovative Produkte.
Damit bereits bestehende Engpässe nicht noch weiter verschärft werden, braucht es angesichts der momentanen Situation jetzt schnelle und pragmatische Lösungen, um benötigte Medizintechnik in ausreichender Form COVID-19-Patienten zu Verfügung zu stellen.
Folge 40: Patientendaten-Schutzgesetz als wichtiger Teil einer erfolgreichen digitalen Transformation

Die erfolgreiche digitale Transformation der Gesundheitswirtschaft in Deutschland setzt voraus, dass verschiedene Elemente aufeinander abgestimmt werden. Deutlich wird das an den Regelungen zur Umsetzung der elektronischen Patientenakte (ePA) im Patientendaten-Schutzgesetz (PDSG).
Das neue PDSG adressiert genau diesen Aspekt der digitalen Transformation: Es definiert die inhaltlichen Eckpunkte zur Umsetzung der ePA und die Anforderungen an einen interoperablen Austausch von Daten. Auf dieser Basis wird es zum Beispiel möglich, dass Versicherte Daten aus ihrer ePA für die Forschung zur Verfügung stellen können. Das PDSG trägt so zu einer strategischen Umsetzung der dringend notwendigen Digitalisierung der Gesundheitswirtschaft bei, in dem die ePA zu einem zentralen Element der digitalen Transformation wird. Im Gesetz wird die Aufklärung der Versicherten über die Inhalte und Funktion der ePA berücksichtigt. Ebenso stärkt es die Datensouveränität der Versicherten, in dem es ihnen die alleinige Entscheidungsfreiheit über den Umgang ihrer Daten zuspricht.
Durch das PDSG wird die medizinische Versorgung weiter verbessert und eine vielfältig erreichbare medizinische Versorgung gewährleistet. So trägt es in der Folge auch zu einer Verbesserung der Gesundheit und Lebensqualität der Versicherten bei.
Folge 39: Telemedizin verbessert Gesundheitsversorgung spürbar

Der Einsatz von Telemedizin kann die Versorgung von Patienten spürbar verbessern. Wie eine Studie zeigt, müssen Patienten, die unter Herzinsuffizienz leiden erstens weniger Tage stationär im Krankenhaus verbringen. Zudem erhöht sich die Überlebensrate im ersten Jahr mit zusätzlicher telemedizinischen Versorgung um fast ein Drittel.
Vor allem im ländlichen Raum lässt sich also die Gesundheitsversorgung bei Herzleiden durch Telemedizin und Telemonitoring besser und regelmäßiger durchführen. Da in diesen Regionen meist der Hausarzt in erster Linie zuständig ist, kann durch telemedizinische Anwendungen bestehende strukturelle Defizite ausgeglichen werden. Zudem ist Herzschwäche die häufigste Ursache für Krankenhausaufenthalte in den letzten 10 Jahren. Chronische Herzinsuffizienz ist auch in Deutschland weit verbreitet: Rund 1,8 Millionen leiden darunter, 300.000 kommen jährlich hinzu.
Folge 38: Zu wenig Benannte Stellen für MDR: Innovation in der medizinischen Versorgung gefährdet

Die geringe Zahl der Benannten Stellen für die Medical Device Regulation wird immer mehr zu einem Problem für die Qualität der medizinischen Versorgung. Denn neu entwickelte Produkte und wesentlich weiterentwickelte Bestandsprodukte können erst dann auf den europäischen Markt gebracht werden, wenn eine Konformitätsbewertung nach MDR erfolgt ist. Dafür ist die Beteiligung einer Benannten Stelle notwendig. Während es unter der bisherigen Medizinprodukte-Richtlinie (MDD) über 50 Benannte Stellen in der EU gab, sind für die MDR aktuell nur neun Benannte Stellen offiziell notifiziert. Die Europäische Kommission erwartet, dass bis zum Geltungsbeginn der MDR am 26. Mai 2020 etwa 20 Benannte Stellen für die MDR notifiziert sein werden.
Damit ist absehbar, dass eine große Zahl von Herstellern zum Geltungsbeginn der MDR nicht in der Lage sein werden, neu entwickelte, innovative Produkte auf den europäischen Markt zu bringen. Für das einzelne Unternehmen ist auch nicht sicher vorhersehbar, wann für sie eine Benannte Stelle zur Verfügung stehen wird. Zusätzlich ist zu berücksichtigen, dass die Auditierung durch die Benannte Stelle und die Verfahren zur Konformitätsbewertung für ein Unternehmen sechs bis zwölf Monate in Anspruch nehmen können.
Die Markteinführung eines fertig entwickelten, innovativen Produktes kann sich damit bis weit in das Jahr 2021 verschieben. Neu entwickelte oder wesentlich verbesserte Produkte stehen damit für die medizinische Versorgung nicht zur Verfügung.
Folge 37: 133 Tage vor MDR: Durch unbefriedigenden Umsetzungsstand startet Plan B

Auch 133 Tage vor Geltungsbeginn der MDR am 26. Mai 2020 ist der Umsetzungsstand nach wie vor unbefriedigend. Die Zahl der Benannten Stellen ist weiterhin nicht ausreichend. Wichtige Umsetzungsakte fehlen. Harmonisierte Normen zur Beschreibung der Anforderungen an die Produkte fehlen weiterhin. Zusätzlich hat die Europäische Kommission angekündigt, dass die Datenbank Eudamed, die für die Umsetzung der MDR von zentraler Bedeutung ist, erst im Mai 2022 in vollem Umfang zur Verfügung stehen wird.
Die Hersteller haben ihre Vorbereitungen fristgerecht abgeschlossen, um die Anforderungen der MDR zu erfüllen. Die Mehrheit der Hersteller wird zum Geltungsbeginn aber keine Möglichkeit haben ihre Produkte mit einer CE-Kennzeichnung nach der MDR zu versehen.
Damit hat die Regelung in Artikel 120 MDR eine unerwartete Bedeutung erlangt. Medizinprodukte, die im Rahmen der bisher geltenden Medizinprodukte-Richtlinie (MDD) in Verkehr gebracht werden, können unter bestimmten Bedingungen auch nach dem 26. Mai 2020 weiter in Verkehr gebracht werden. Mit einem Corrigendum haben Europäische Kommission, Mitgliedstaaten und Europäisches Parlament im Dezember 2019 sichergestellt, dass diese Regelung auch für Produkte der Klasse I gilt, die unter der MDR in eine höhere Klasse eingeordnet werden. Damit ist sichergestellt, dass alle Bestandsprodukte zunächst weiter in Verkehr gebracht werden können.
Es handelt sich hierbei aber tatsächlich nur um eine Notlösung: neu entwickelte, innovative Produkte können die Hersteller erst dann in Verkehr bringen, wenn ausreichend Benannte Stellen zur Verfügung stehen. Wann das der Fall sein wird, ist ungewiss.
MedTech-Telegram 2019
Folge 36: Umsetzung MDR: Unbestimmte Verzögerung von Innovationen durch fehlende Benannte Stellen

Bereits vor dem Geltungsbeginn der MDR ist die medizintechnische Industrie mit einer Verzögerung von neuen, innovativen Produkten konfrontiert. Aufgrund der Umstellung auf die Anforderungen der MDR nehmen die Benannten Stellen bereits seit einigen Monaten keine Unterlagen mehr für die Bewertung neuer Produkte der Klassen IIa, IIb und III nach der aktuell noch geltenden EU-Richtlinie über Medizinprodukte (MDD) an. Diese Produkte können deshalb nicht mit einer CE-Kennzeichnung versehen und daher in der EU auch nicht in Verkehr gebracht werden. Gleichzeitig wird für Hersteller eine verlässliche Planung, ab wann sie neue Produkte vor oder nach dem 26. Mai 2020 erstmalig auf den europäischen Markt bringen können, dadurch erschwert, dass noch keine ausreichende Anzahl von Benannten Stellen nach der neuen EU-Verordnung für Medizinprodukte (MDR) verfügbar ist.
Bereits am Markt befindliche Medizinprodukte der Klassen IIa, IIb und III, die über gültige Zertifikate nach der MDD verfügen, können auch nach dem 26. Mai 2020 weiter in Verkehr gebracht werden. Diese Regelung gilt solange die Zertifikate gültig sind, längstens aber bis zum 26. Mai 2024. Allerdings dürfen diese Produkte nicht mehr wesentlich verändert werden. Für diese Produkte gilt damit ein „Innovations-Stopp“. Eine vergleichbare Regelung gilt für Medizinprodukte der Klasse I, die nach der MDR höherklassifiziert werden oder nach der MDR die Mitwirkung einer Benannten Stelle bei der Konformitätsbewertung erfordern.
Für die Hersteller von Medizinprodukten der Klassen IIa, IIb und III bedeutet dass, dass sie erst dann wieder neue Produkte in der EU in Verkehr bringen können, wenn das eigene Unternehmen Zugang zu einer Benannten Stelle nach der MDR hat. Wann dies der Fall ist, ist aus Sicht der einzelnen Unternehmen nicht abzuschätzen. Innovative Medizinprodukte können damit gar nicht oder nur verspätet auf den Markt gebracht werden. Je länger dieser Zustand andauert, desto stärker kann die wirtschaftliche Existenz des einzelnen Unternehmens bedroht sein.
Folge 35: Maßnahmen für Cybersicherheit in den Fokus rücken

Durch die zunehmende Anzahl von Cyberangriffen muss bei allen medizinischen Leistungserbringern die Absicherung des IT-Netzes auf die Stufe höchster Priorität rücken. Derzeit sind nur die Krankenhäuser, die nach dem IT-Sicherheitsgesetz zur Gruppe der kritischen Infrastruktur zählen, dazu verpflichtet, ein umfassendes IT-Sicherheitskonzept auf dem Stand der Technik zu implementieren und regelmäßig zu aktualisieren.
Zu einem umfassenden Sicherheitskonzept für das eigene Netzwerk und die darin betriebenen IT-Systeme und Medizingeräte gehören ein klar definiertes System von Zugriffs- und Nutzungsrechten durch LogControl-Prozesse sowie eine strikte Überwachung des Rechtemanagements. Ungewöhnliche oder nicht autorisierte Zugriffe auf Daten müssen gemeldet und geahndet werden. Damit können Cyberangriffe erkannt und abgewehrt werden.
Folge 34: Gesetzgeber korrigiert „Erprobungsregel“ zur Erzeugung von Evidenz

Bisherige gesetzliche Lösungsansätze: „Erprobungsregel“ und „Frühe Nutzenbewertung“
Im Jahr 2012 trat das Versorgungsstrukturgesetzes der Gesetzlichen Krankenversicherungen (GKV) in Kraft. Damit wurde auch der § 137e SGB V (Sozialgesetzbuch, Buch fünf) eingeführt, durch den Hersteller nun die Möglichkeit haben, die Aufnahme von Methoden in den Leistungskatalog der GKV – primär ambulant – aktiv voranzutreiben. Voraussetzung für die sogenannte Erprobungsregel ist, dass das Potential einer Methode erkennbar ist, aber noch keine hinreichende Evidenz vorliegt.
2015 trat das GKV-Versorgungsstärkungsgesetz in Kraft. Der darin enthaltene § 137h SGB V gibt dem Gemeinsamen Bundesausschuss (G-BA) die Möglichkeit, unter besonderen Voraussetzungen selbst eine (frühe) Nutzenbewertung im stationären Bereich auszulösen. Die Regelungen der §§ 137e und 137h – gerade auch dort, wo 137h zu einer Erprobung führt – haben sich jedoch als wenig praktikabel erwiesen.
Korrektur durch das Terminservice- und Versorgungsgesetz (TSVG)
Die gesetzlichen Neu-Regelungen des TSVG sehen unter anderem vor,
- dass die Hersteller Studien im Rahmen einer Erprobungsrichtlinie weiterhin auf eigene Kosten selbst beauftragen (und bezahlen) können, aber nicht mehr müssen. Alle anderen Erprobungsstudien werden vom G-BA durchgeführt und finanziert. Dies sollte auch der Trittbrettfahrerproblematik entgegenwirken. Alle betroffenen Hersteller haben dadurch ein Interesse, gleichartig an der Evidenzerzeugung mitzuwirken.
- dass die vom G-BA sehr restriktiv ausgelegte „Potenzialprüfung" vom Gesetzgeber wieder abgeschafft wird. Dies verkürzt den Prozess verkürzen und verbessert dessen Kalkulierbarkeit.
- dass die Krankenhäuser bei ihren Nutzenbewertungs-Anträgen (NUB) künftig das Einvernehmen mit dem betroffenen Anbieter herstellen müssen. Bisher reichte es aus, sich ins Benehmen zu setzen. Diese Verbesserung im stationären Bereich hilft den Herstellern zur rechtzeitigen Sammlung von Evidenz.
- dass die Beratungsmöglichkeiten für Unternehmen durch den G-BA erweitert werden. Auch das erhöht die Kalkulierbarkeit des Verfahrens in Bezug auf die jeweiligen Evidenzanforderungen.
Bestehende Problemlage
- Die Anzahl möglicher Erprobungen wird auch von der Verfügbarkeit der Haushaltsmittel des G-BA abhängen. Aufgrund der vorab zu erlasssenden Erprobungsrichtlinie könnte das auch die Erprobungen ausbremsen, bei denen Hersteller zur Kostenübernahme für die Studie bereit sind. Die Einführung eines transparenten Rankings von Bewertungsverfahren würde die Planbarkeit für alle Seiten erleichtern.
- Weiterhin fehlt für die Branche ein praktikables Konzept zur Erzeugung von Evidenz. Neben dem generellen wissenschaftlichen Know-how zur evidenzbasierten Medizin sollte ein Instrumentarium zur Methodenbewertung mit Medizinprodukten unter Führung des Bundesministerium für Bildung und Forschung entwickelt werden.
Folge 33: Export Elektromedizinischer Technik steigt und hat großen Anteil an industrieller Gesundheitswirtschaft

Die Hersteller elektromedizinischer Technik in Deutschland erzielen in ihrer Branche gut zwei Drittel des Umsatzes im Export. Diese Entwicklung bestätigen auch die ersten aktuellen Zahlen aus dem Jahr 2019.
In den ersten acht Monaten des Jahres 2019 hat der Export elektromedizinischer Produkte gegenüber dem gleichen Zeitraum in 2018 um 10,2 Prozent auf 9,5 Milliarden Euro zugenommen. Hält diese Entwicklung an, könnte die Gesamtsumme der Exporte an elektromedizinischer Technik damit im Jahr 2019 den Wert von 15 Milliarden Euro übersteigen.
Im Jahr 2018 entfielen 11,2 Prozent der Gesamtexporte der industriellen Gesundheitswirtschaft auf Produkte der elektromedizinischen Technik. Zur elektromedizinischen Technik gehören neben Geräten für die medizinische Bildgebung, wie CTs und MRTs, auch Geräte für Patientenüberwachung und Intensivmedizin, Geräte zum Einsatz im Operationsraum, wie Geräte für Hochfrequenz-Chirurgie und weitere Geräte und Einrichtungen für Krankenhäuser und Arztpraxen.
Der Exporterfolg der deutschen elektromedizinischen Technik wird durch eine Reihe international bedeutender Messen und Kongresse medizinischer Fachgesellschaften in Deutschland unterstützt.
Folge 32: Im Alltag ist die Gesundheit längst digital

Beim Thema Gesundheit findet die Digitalisierung im Alltag schon längst statt. Aktuell verwenden zwei von drei Smartphone-Benutzern Gesundheitsapps, um z. B. ihr Gewicht zu reduzieren oder die Ernährung ausgewogener zu gestalten. Am beliebtesten sind Gesundheits-, Fitness-, Gewichts- oder Ernährungsapps. Aber auch Applikationen, die Körper- und Fitnessdaten wie zum Beispiel Herzfrequenz, Blutdruck oder gegangene Schritte aufzeichnen, sind überaus beliebt.
Die Menschen in Deutschland sind damit gegenüber der Digitalisierung im Gesundheitswesen sehr aufgeschlossen und sehen einen hohen Nutzen bei der Verwendung von Gesundheitsapps.
Folge 31: KI in der Medizin – Chance und Herausforderung zugleich

Der Einsatz von Künstlicher Intelligenz (KI) bei der Diagnostik findet in Deutschland große Unterstützung. Nach einer Umfrage, die vom Bundesministerium für Bildung und Forschung gefördert wurde, befürworten 67 Prozent der Befragten den Einsatz von KI. Geht es um das KI entgegengebrachte Vertrauen, ist das Meinungsbild weniger eindeutig: Ein gutes Drittel schenkt Künstlicher Intelligenz in etwa gleich viel Vertrauen wie einem Arzt (35 Prozent). Allerdings wäre mehr als die Hälfte (57 Prozent) dazu bereit, die eigenen Gesundheitsdaten anonymisiert zur Verfügung zu stellen, damit KI-Diagnosen künftig noch besser werden könnten.
Das zeigt, dass der Einsatz von KI für eine noch bessere Gesundheitsversorgung Chance und Herausforderung zugleich bedeutet. Das Zusammenspiel von Mensch und Maschine birgt großes Potenzial. In der Medizin ist die KI nicht mehr wegzudenken. Daher braucht es schlussendlich mehr Aufklärung über die Vorteile des Einsatzes von Künstlicher Intelligenz in der Medizin, um das Vertrauen weiter zu stärken.
Folge 30: Digitale Gesundheitswirtschaft ist ein Zukunftsmarkt

Die digitale Gesundheitswirtschaft setzt sich zusammen aus Digitaler Medizintechnik und E-Health – wozu unter anderem Geräte und Dienstleistungen der Informations- und Kommunikationstechnik gehören. Die Branche ist ein absoluter Zukunftsmarkt und folgt dem wirtschaftlichen Trend der gesamten Gesundheitswirtschaft. 65.300 Erwerbstätige erzielten eine Bruttowertschöpfung (BWS) von rund sechs Milliarden Euro. Dies entspricht einem Anteil von fast sieben Prozent sowohl am Arbeitsmarkt der industriellen Gesundheitswirtschaft (iGW) wie auch an der BWS der iGW. Darüber hinaus wurden seit 2007 13.500 neue Arbeitsplätze geschaffen. Die Außenhandelsbilanz ist leicht höher: Knapp fünf Milliarden Euro werden durch Exporte von Gütern der digitalen Gesundheitswirtschaft umgesetzt. Die Importquote hingegen liegt bei etwas über vier Milliarden Euro.
Folge 29: Die Gesundheitswirtschaft ist eine starke Wirtschaftsbranche

Mit einem Gesamtumsatz von 370 Milliarden Euro, einem Anteil von zwölf Prozent am Bruttoinlandsprodukt (BIP) und einer gesamtdeutschen Exportquote von acht Prozent leistet die Gesundheitswirtschaft (GW) einen bedeutenden Beitrag zur Wirtschaftskraft in Deutschland. Die Branche ist weiterhin auf Wachstumskurs und weist eine hohe Bruttowertschöpfung (370 Milliarden Euro) auf.
Die industrielle Gesundheitswirtschaft (iGW) ist eine der größten und bedeutendsten Teilbranchen der GW in Deutschland. 23 Prozent der Bruttowertschöpfung der gesamten Gesundheitswirtschaft entfallen auf die iGW. Das entspricht 84 Milliarden Euro. Sie ist die am stärksten globalisierte Branche innerhalb der Gesundheitswirtschaft und steigert ihr Exportvolumen stetig, auf mittlerweile über 121 Milliarden Euro (92 Prozent der GW). Der Gesamtumsatz beträgt 203 Milliarden Euro.
Die MedTech-Branche ist innerhalb der industriellen Gesundheitswirtschaft ein bedeutender Teilbereich. Mit einem Gesamtumsatz von 30 Milliarden Euro und einer Bruttowertschöpfung von 16 Milliarden Euro (vier Prozent der GW) leistet die MedTech-Branche konstant einen wichtigen Beitrag zum Wachstum der gesamten Gesundheitswirtschaft. Das zeigt sich auch in der seit 2010 kontinuierlich steigenden Exportquote, die 23 Prozent (30 Milliarden Euro) der deutschen Gesundheitswirtschaft ausmacht. Die MedTech-Branche ist damit auch ein wesentlicher Bestandteil der Wertschöpfungskette Gesundheit.
Folge 28: Die Gesundheitswirtschaft als Garant für langfristig sichere Arbeitsplätze

Die Zahl der Arbeitsplätze in der Gesundheitswirtschaft wächst weiter kontinuierlich: Mit 7,6 Millionen Beschäftigten und einem Anteil von 17 Prozent am gesamten deutschen Arbeitsmarkt ist jeder sechste Arbeitsplatz in der Gesundheitswirtschaft angesiedelt. Damit bleibt die Gesundheitswirtschaft ein Jobmotor und ein Garant für langfristig sichere Arbeitsplätze.
Jeder achte Beschäftigte in der Gesundheitswirtschaft ist in der industrielle Gesundheitswirtschaft (iGW) tätig. Das entspricht einem Anteil von 13 Prozent an der gesamten Gesundheitswirtschaft und rund einer Million Erwerbstätiger in absoluten Zahlen.
In der MedTech-Branche steigt die Anzahl der Erwerbstätigen ebenfalls leicht: 200.000 Beschäftigte sind in der Herstellung von Medizinprodukten und Medizintechnik tätig. Damit liegt der Anteil an den Erwerbstätigen der gesamten Gesundheitswirtschaft bei drei Prozent. Jeder fünfte Arbeitsplatz in der iGW ist im MedTech-Bereich angesiedelt, was die Branche zu einem sehr wichtigen Bestandteil der Gesundheitswirtschaft macht.
Folge 25: ZVEI-Umfrage: MDR wird Produktangebot fühlbar einschränken
Eine Umfrage unter ZVEI-Mitgliedsunternehmen hat ergeben, dass über die Hälfte der Medizintechnikhersteller heute verfügbare Medizinprodukte wegen des Aufwandes für eine erneute Zulassung nach der MDR vom Markt nehmen wird. Das betrifft laut der Befragung zwischen zwei und zehn Prozent des heutigen Produktportfolios. Konkret sind je nach Hersteller zwischen zwei und 250 Produkte betroffen.
Folge 23: Der Umsetzungsstand der Medical Device Regulation ist kritisch
Die Übergangsfrist der neuen MDR ist bereits zu zwei Dritteln verstrichen. Bei wesentlichen Punkten, die für die Umsetzung durch Unternehmen und Behörden wichtig sind, ist der Fortschritt nicht ausreichend, um eine rechtzeitige Umsetzung zu gewährleisten:
- Weiterhin fehlen wesentliche Rechtsakte und Dokumente für die Umsetzung der MDR
- Bis heute gibt es keine ausreichende Anzahl an Benannten Stellen, welche die notwendige Akkreditierung erfolgreich abgeschlossen haben.
- Es gibt bisher keine offiziell europäisch harmonisierten Normen, gegen welche die Benannten Stellen die Konformität der Medizinprodukte prüfen können.
Folge 22: Medical Device Regulation: Steigende Zahl der zu prüfenden Produkte verursacht Engpass bei den Benannten Stellen
Mit Wirksamkeit der Medical Device Regulation erhöht sich durch neue Klassifizierungsregeln die Zahl der Medizinprodukte, die von eine Benannten Stellen begutachtet werden müssen, deutlich. Das wäre schon problematisch, wenn die Zahl der Benannten Stellen in Europa unverändert bliebe. Denn die 58 Stellen sind bereits heute so ausgelastet, dass die Bearbeitungszeiten deutlich steigen.
Mit der neuen MDR müssen sich jedoch auch die Benannte Stellen selbst komplett neu akkreditieren lassen. Vermutlich werden in der zweiten Jahreshälfte 2019 die ersten Stellen so weit sein, dass sie nach der MDR zertifizieren können. Dass am Stichtag 26.5.2020 jedoch wieder 58 Benannte Stellen oder sogar mehr zur Verfügung stehen werden, um neue sowie bestehende Medizinprodukte zuzulassen, ist unwahrscheinlich.
Dieser Engpass an Benannten Stellen bedroht die lückenlose Versorgung mit Medizinprodukten.
Folge 21: Nachweis oder Erzeugung von Evidenz ist durch gesetzlichen Rahmen gefordert
Wenn zum Zeitpunkt der Überprüfung durch den G-BA keine ausreichende Evidenz-Prüfung vorliegt, muss diese „nachgereicht“ werden. Dazu hat es über § 137e und 137h SGB V gesetzliche Neuregelungen für beide Versorgungssektoren gegeben.
Gesetzlicher Lösungsansatz 1: Erprobungsregel nach § 137e SGB V
Seit Inkrafttreten des GKV-Versorgungsstrukturgesetzes 2012 und des damit eingeführten § 137e SGB V besteht für Hersteller die Möglichkeit, die Aufnahme von Methoden in den Leistungskatalog der GKV aktiv voranzutreiben. Voraussetzung für die sogenannte Erprobungsregel ist, dass das Potential einer Methode erkennbar ist, aber noch keine hinreichende Evidenz vorliegt.
Aussage 1: Die Verfahrensdauer bis zur Erprobungsrichtlinie des G-BA beträgt regelmäßig mehr als 30 Monate. Hinzu kommt die Dauer der eigentlichen Studie, sodass insgesamt mindestens von einer 5-jährigen Verzögerung für den Eingang einer neuen Methode ins Vergütungssystem auszuheben ist.
Aussage 2: Das Studiendesign ist für den Hersteller nur begrenzt zu beeinflussen, die Gesamtkosten der Studie sind zunächst kaum vorhersehbar.
Aussage 3: Hinzu kommt die Trittbrettfahrerproblematik, da keiner der betroffenen Hersteller zur Teilnahme an der Studie und zur anteiligen Kostenübernahme verpflichtet ist.
Gesetzlicher Lösungsansatz 2: Frühe Nutzenbewertung nach §137h SGB V
Seit Inkrafttreten des GKV-Versorgungsstärkungsgesetzes 2015 und des damit eingeführten § 137h SGB V besteht für den G-BA die Möglichkeit, bei erstmaligen NUB-Anträgen eines Krankenhauses unter besonderen Voraussetzungen eine Nutzenbewertung auszulösen. Es muss sich um eine Methode mit einem neuartigen wissenschaftlichen Konzept handeln und invasiv zur Anwendung kommen.
Aussage 1: die innovationsbewährte „Erlaubnis mit Verbotsvorbehalt“ im stationären Sektor wird eingeschränkt und die moderne Gesundheitsversorgung damit mit Unsicherheit behaftet
Aussage 2: eine Nutzenbewertung kann jetzt auch ohne Wissen des Herstellers durch ein beantragendes Krankenhaus ausgelöst werden und den Hersteller damit unvorbereitet treffen
Aussage 3: die Unklarheiten und Hemmnisse neuer Technologien verstärken sich dadurch, dass mögliche Studien zur neuen Methode nur mitbeantragende Krankenhäuser einbeziehen dürfen
Folge 20: Evidenz gewinnt zentrale Bedeutung für die MedTech-Industrie
Zentrale Bedeutung von Evidenz in der Gesundheitsversorgung [oberer Kasten]
Evidenz, also der Nachweis eines Patientennutzens aus medizinischen Untersuchungen oder Behandlungen, ist für den Bereich der Medizintechnik ein absolutes, strategisches Zielkriterium geworden. Ohne Evidenz werden neue medizinische Methoden (Interventionen), definiert als prozedurale Anwendung von Medizinprodukten bei medizinischen Fragestellungen (Indikationen), in der deutschen Gesundheitsversorgung (ambulanter und stationärer Bereich) nicht vergütet oder zumindest nicht höher vergütet als bisherige Verfahren.
Selbstverwaltung folgt gesundheitspolitischer Evidenz-Anforderung [linker Kasten]
Der Gemeinsame Bundesausschuss (G-BA) als höchstes Organ der deutschen Selbstverwaltung ist zuständig für die Pflege des Leistungskatalogs der Gesetzlichen Krankenversicherung. Bei der Aufnahme von medizinischen Leistungen in der Vergütungssystematik entscheidet der G-BA auf Basis seines gesetzlichen Auftrags, nutzt medizinisch-wissenschaftliche Grundlagen und trifft ergänzende Wertentscheidungen. Hauptkriterien sind dabei evidenz-basierter medizinischer Nutzen, das Wirtschaftlichkeitsgebot im Kontext alternativer Behandlungen und realen Versorgungsbedingungen in Deutschland.
Industrie steht vor Evidenz-Herausforderung hinsichtlich Innovationsfähigkeit [rechter Kasten]
Evidenznachweise sind umso aufwendiger, je kleiner der medizinische Effekt beim Patienten ist. Da zudem die meisten Produkte als Schrittinnovationen mit eher kleinen Nutzenzugewinnen einzustufen sind, droht hier eine Bremse für die Innovationsfähigkeit des gesamten Gesundheitssystems. Denn der relative Aufwand steht regelmäßig im Gegensatz zu den vermeintlichen Erlösmöglichkeiten mit Produkten oder Produktentwicklungen. Es fehlen nachvollziehbare Entscheidungskriterien darüber, wann ein Produkt eine neue Methode begründet und wann nicht, die Verfahrensdauer von „Erprobungen“ (> 5 Jahre) entsprechen nicht den engen Innovationszyklen, die Gesamtkosten der zum Evidenznachweis erforderlichen Studien sowie die Trittbrettfahrerproblematik verschärfen den Mangel valider Kalkulationsgrundlagen.
Folge 19: Voraussetzungen für sektorübergreifende Datenvernetzung schaffen
Eine sektorübergreifende Kommunikation von Daten ist nur möglich, wenn Daten in einheitlicher Form vorliegen. Dafür ist neben der technischen Standardisierung auch ein gemeinsames Verständnis von Arbeitsweisen und Abläufen notwendig. Um dies sicherstellen zu können, bedarf es einer neutralen, öffentlichen Stelle, die unter Beteiligung aller Akteure im Gesundheitssystem effiziente, interoperable Abläufe beschreibt und daraus technische Spezifikationen auf Basis internationaler Standards entwickelt. Dabei muss die Anbindung an die Telematikinfrastruktur berücksichtigt werden sowie finanzielle Anreize zur Umsetzung geschaffen werden. Nur so kann eine bundesweite Verbindlichkeit und „digitale Sichtweite“ aller Leistungserbringer sichergestellt werden. Wichtig dabei ist, dass die Anwender bei den technischen Lösungen direkt eingebunden werden. Nur so kann sichergestellt werden, dass die technischen Normen im beabsichtigten Anwendungsgebiet auch tatsächlich nutzbar sind.
Folge 18: Entwicklung flexibler Instrumente zur Methodenbewertung
Um Patienten insbesondere einen schnellen Zugang zu innovativen und digitalen Versorgungsangeboten zu gewähren, sind transparente und verlässliche Wege in die Regelversorgung im GKV-System notwendig. Aber die bestehenden gesetzlichen Vorgaben sind oftmals nicht mehr zeitgemäß: zu langwierig, methodisch zu kompliziert und zu kostenintensiv. Auch die kurzlebigen Innovationszyklen digitaler Angebote werden dabei nicht ausreichend berücksichtigt. Bis dato werden fast ausschließlich randomisierte, kontrollierte Studien (RCTs) als Evidenznachweis akzeptiert.
Deshalb ist es notwendig, dass
- die retrospektive Nutzenbewertung als weiteren Weg zur Nutzenbewertung zu ermöglichen,
- Forschungsprojekte zur zukünftigen Berücksichtigung von weiteren Nutzen- bzw. Surrogatparametern und deren Nachweis als Alternative zu RCTs angestoßen werden,
- die Verfahren zur Genehmigung von IV-Verträgen nach §§ 140a ff SGB V entbürokratisiert werden.
Auch mit diesen Änderungen kann der Nachweis von medizinischer Evidenz auf dem notwendigen Niveau erfolgen. Übergeordnetes Ziel muss es sein, transparente und verlässliche Wege in die Regelversorgung des GKV-Systems zu schaffen.
Folge 17: Maßnahmen zur Cybersicherheit in den Fokus rücken
Moderne Gesundheitsversorgung ist ohne vernetzte Medizintechnik nicht mehr möglich. Durch die Vernetzung sind vermehrt auch Leistungserbringer Angriffsziele für Cyberattacken geworden. Bisher sind jedoch nur Krankenhäuser, die zur Gruppe der kritischen Infrastruktur zählen, verpflichtet, ein IT-Sicherheitskonzept auf dem Stand der Technik zu implementieren und regelmäßig zu aktualisieren. Ein umfassendes Cybersicherheitskonzept muss medizintechnische Geräte einschließen, die innerhalb des jeweiligen Netzwerks betrieben werden.
Aber auch die Hersteller von Medizinprodukten sind verpflichtet, die veränderte Gefährdungslage zu berücksichtigen. Medizintechnische Geräte müssen einen Beitrag zur Cybersicherheit des gesamten Systems einer Einrichtung leisten.
Im Mai 2018 hat das Bundesamt für Sicherheit in der Informationstechnik (BSI) unter Mitarbeit des ZVEI eine Empfehlung „Cyber-Sicherheitsanforderungen an netzwerkfähige Medizinprodukte" veröffentlicht. Diese BSI-Empfehlung soll Hersteller von netzwerkfähigen Medizinprodukten, flankierend zu den regulatorischen Vorgaben, bei der Implementierung und Aufrechterhaltung eines angemessenen Cybersicherheitsniveaus nach dem Stand der Technik unterstützen. Darüber hinaus sichert der neu gegründete Expertenkreis „CyberMed" innerhalb der „Allianz für Cyber-Sicherheit“ einen regelmäßigen Austausch der verschiedenen Stakeholder (BSI, Industrieverbände, Betreiberverbände). Derzeit arbeitet der Expertenkreis an dem Ziel, dass Betreiber zukünftig bereits frühzeitig im Beschaffungsprozess produktbegleitende Informationen über die implementierten Cybersicherheitsmaßnahmen in Medizingeräten in standardisierter Form erhalten.
Folge 16: Rechtssicherheit bei der Nutzung von personenbezogenen Daten schaffen
Die Digitalisierung der Gesundheitswirtschaft ermöglicht eine individuelle Gesundheitsversorgung, die sich an den Bedürfnissen und Lebensumständen des einzelnen Menschen orientiert. Dabei gibt es verschiedene Aspekte, die zu einem verantwortungsvollen Umgang mit der Digitalisierung der Gesundheitswirtschaft führen. Ein wesentlicher Bereich ist das Thema Datenschutz. Hier hat der ZVEI drei konkrete Vorschläge:
- Aufgrund der föderalen Struktur und der unterschiedlichen Länderzuständigkeiten im Bereich des Datenschutzes es ist zielführend, ein bundesweit einheitliches Nutzungsmodell für personenbezogene Daten für Verwendungen in den Bereichen Forschung und Entwicklung zur Verfügung zu stellen. Dafür bedarf es eines gesetzlich definierten Rahmens für die Nutzung von personenbezogenen Daten mit einer Muster-einwilligung, die auch die Möglichkeit einer Datenspende einbezieht.
- Nach EU-DSGVO ist bei der Nutzung von Daten ohne Personenbezug keine Einwilligung des Patienten notwendig. Wann aber der Personenbezug gegeben ist und wann nicht, ist bis dato nicht festgelegt. Deshalb bedarf es eines klar geregelten Rahmens für die Datennutzung ohne Einwilligung. Dafür ist eine gesetzliche Definition von Kriterien für den Entfall des Personenbezugs notwendig.
- Das aktuelle Datenschutzmodell in Deutschland beruht auf Datensparsamkeit und beschränkt die Nutzung der Daten auf den Grund der ursprünglichen Datenerhebung. Daten, die im Rahmen einer Diagnose erhoben worden sind, sollten jedoch zusätzlich auch für die Forschung verwendet werden können. Das geht heute aber nur, wenn der Patient schon bei der Diagnose genau über den Zweck der Forschung informiert wurde und dem zugestimmt hat. Wenn nur eine Woche später dieselben Daten zur Forschung an einem anderen Krankheitsbild genutzt werden sollen, ist bereits das nicht möglich. Eine digitale, auf Daten basierende Gesundheitsversorgung entwickelt sich aber nur dann, wenn eine Nutzung von Daten auch außerhalb des ursprünglichen Zwecks der Datenerhebung möglich ist. Eine gesetzliche Regelung zur Weitergabe von Adressdaten im Falle einer nachträglichen Einwilligung für Forschungs- und Versorgungszwecke ist deshalb zwingend notwendig.
MedTech-Telegram 2018
Folge 15: Fazit der Reihe MedTech-Telegram: Gemeinsam können wir ein Optimum an Gesundheit erreichen
Rückblickend auf die MedTech-Telegramme stellen wir fest: Deutschland braucht eine Strategie für die Digitalisierung der Gesundheitswirtschaft. Für eine erfolgreiche Umsetzung bedarf es einer strategischen Ausrichtung nicht nur gesundheitspolitischer, sondern gesamtgesellschaftlicher Ziele. Diese müssen zuvor in einem eHealth-Zielbild festgelegt werden. Erst dann können alle Beteiligten im Gesundheitssystem die richtigen Maßnahmen in den jeweiligen Bereichen umsetzen, die anschließend in Summe zum gewünschten Ziel führen. Eine gesonderte Rolle kommt dabei den Patienten zu. Sie sind nicht länger passive Zuschauer, sondern werden zu Managern ihrer Gesundheit. Dies gelingt aber nur, wenn sie über alle Chancen und Risiken von Versorgungsmaßnahmen aufgeklärt sind und auf dieser Basis eine bewusste Entscheidung treffen können. Voraussetzung dafür ist auch eine sichergestellte Finanzierung. Denn nur durch eine langfristige Finanzierung kann eine nachhaltige Gesundheitsversorgung gewährleistet werden.
Innovative Medizintechnik ist für die moderne Gesundheitsversorgung unentbehrlich und die Branche wird einen wesentlichen Beitrag dazu leisten. Ein Optimum an Gesundheit kann aber nur erreicht werden, wenn alle Beteiligten im Gesundheitssystem an einem Strang ziehen und die politischen Akteure entsprechend handeln. Konkret braucht Deutschland für die digitale Transformation des Gesundheitssystems:
- einen Diskussionsprozess für ein nationales eHealth-Zielbild unter Beteiligung aller Akteure im Gesundheitssystem,
- ein Investitionsprogramm des Bundes und der Länder für digitale Infrastrukturen und
- eine bundesweite Aufklärungskampagne, die die Chancen der Digitalisierung der Gesundheitsversorgung in den Fokus rückt.
Folge 14: Negative Folgen der Medical Device Regulation auf den Standort Deutschland vermeiden
Ziel der europäischen Medizinprodukteverordnung (Medical Device Regulation – MDR) ist es, das reibungslose Funktionieren des Binnenmarkts von Medizinprodukten zu gewährleisten sowie den Schutz von Patienten und Anwendern in Europa sicherzustellen. Innerhalb der MDR sind deshalb zahlreiche Anforderungen an die Hersteller, Benannten Stellen und Akteure im Gesundheitswesen formuliert, um so Sicherheit und Qualität von Medizinprodukten sicherzustellen. Gleichzeitig soll die klein- und mittelständische Struktur der Branche Berücksichtigung finden. Die MDR wird am 26. Mai 2020 – nach einer Übergangsfrist von drei Jahren – die heute geltende Medizinprodukte-Richtlinie (MDD) und das deutsche Medizinproduktegesetz (MPG) ablösen. Im Vergleich zu anderen Regularien ist diese Frist recht kurz bemessen und erhöht damit den Druck auf die Hersteller.
Eine zusätzliche Herausforderung ist, dass wichtige Rechtsakte zur Umsetzung der MDR immer noch nicht vorliegen. Bis jetzt ist außerdem keine einzige der unabhängigen „Benannten Stellen“, die für den Marktzugang der Produkte eine entscheidende Rolle spielen, akkreditiert.“ Ohne Zugang zu einer „Benannten Stelle“ droht die Gefahr, dass Unternehmen im Mai 2020 den Vertrieb von Medizinprodukten in der EU einstellen müssen. Gerade kleine und mittelständische Unternehmen sind dann in ihrer wirtschaftlichen Existenz bedroht – und diese Unternehmen machen über 90 Prozent der Betriebe in Deutschland aus. Auch Innovationen in der Medizintechnik sind durch reduzierte Forschungsbudgets in Gefahr. Insbesondere vor dem Hintergrund einer alternden Bevölkerung, Zunahme von Multimorbidität und fehlenden Fach-/Nachwuchskräfte ist dies besonders beachtenswert. In der Zukunft werden zunehmend individualisierte Therapien notwendig sein und die Medizintechnik leistet hierfür einen wesentlichen Beitrag.
Folge 13: Positives Feedback auf digitale Angebote im Gesundheitsbereich
Die Digitalisierung der Gesundheitswirtschaft birgt ein riesiges Potenzial für eine bessere und effizientere Versorgung. Wird diese erfolgreich umgesetzt, wird eine individualisierte Gesundheitsversorgung möglich, bei der für jeden einzelnen Patienten die für ihn am besten geeignete Diagnose und Therapie ausgewählt wird. In der Zukunft wird eine leistungsfähige Patientenversorgung nur noch mit Hilfe digitaler Versorgungsangebote funktionieren.
Die Gesundheitsversorgung von morgen wird weiterhin viel in Arztpraxen und Krankenhäusern stattfinden. Aber nicht mehr ausschließlich dort. Auch das ist ein Effekt der Digitalisierung in der Gesundheitswirtschaft. In Zukunft wird vieles von den Patienten selbst zu Hause oder mobil erledigt werden können – gerade bei chronischen Erkrankungen. Eine solche Form der Gesundheitsversorgung ist auch der Wunsch der Bevölkerung.
Folge 12: Digitalisierung der Gesundheitsversorgung ermöglicht erhebliche Kosteneinsparungen
Der Einsatz digitaler Technologien senkt Gesundheits- und Versorgungskosten um 12 Prozent und führt damit zu einem Effizienzpotenzial in Höhe von 34 Milliarden Euro jährlich. Dieses entsteht einerseits durch Effizienzsteigerungen, andererseits aus der Reduzierung unnötiger Nachfrage durch z.B. die Vermeidung von Doppeluntersuchungen oder Minimierung/Verhinderung unnötiger Krankenhauseinweisungen. Mit 6,4 Milliarden Euro bringt die elektronische Gesundheitsakte die größte Einsparung. Insgesamt kommen 70 Prozent des erreichbaren Nutzens bei den Leistungserbringern und 30 Prozent bei den Krankenversicherungen an.
Folge 11: Großes Finanzierungsdefizit in der Krankenhaus-IT
Die Potenziale durch die Digitalisierung im Krankenhaus sind groß: Angefangen bei der Vernetzung medizinischer Geräte, Informationssysteme sowie von Behandlungs- und Versorgungsprozessen über sektorenübergreifende Kommunikation, digitales Entlassungsmanagement und telemedizinische Anwendungen bis hin zu individualisierten Medizinprodukten, flexibleren Arbeitsabläufen und letztendlich Kosteneinsparungen. Dennoch fehlen den Krankenhäusern die dafür notwendigen Investitionsmittel, u.a. weil die Bundesländer ihrer Investitionsverantwortung seit Jahren nicht nachkommen. Deshalb fordert der ZVEI neben einer monistischen Krankenhausfinanzierung ein Investitionsprogramm des Bundes und der Länder, um die Digitalisierung der Gesundheitswirtschaft erfolgreich umzusetzen.
Folge 10: Bei eHealth ist Deutschland im Branchenvergleich Schlusslicht – Jetzt Dialogplattform für eHealth-Strategie aufbauen
Nicht nur im internationalen, sondern auch im nationalen Branchenvergleich ist und bleibt das Gesundheitssystem bei der digitalen Transformation Schlusslicht. Und dies mindestens bis zum Jahr 2023. Das muss sich dringend ändern.
Die Digitalisierung der Gesundheitswirtschaft ist gekennzeichnet durch ein zunehmendes Zusammenwachsen von Branchen und Produkten, aber auch von Politikfeldern, und dadurch besonders komplex. Um die Digitalisierung voranzutreiben, müssen deshalb alle relevanten Kompetenzen zusammengeführt werden. Der ZVEI setzt sich für eine ressort- und branchenübergreifende Dialogplattform unter zentraler politischer Moderation ein. Ziel ist die gemeinsame Erarbeitung und Abstimmung eines nationalen eHealth-Zielbildes, dem bestehende politische Strategien oder notwendige neue Strategien zugeordnet und entsprechende Aktionspläne gemeinsam erarbeitet und umgesetzt werden können
Folge 9: Bei eHealth hinkt Deutschland im Ländervergleich hinterher – Nationales eHealth-Zielbild zwingend notwendig
Um die Digitalisierung der Gesundheitsversorgung erfolgreich zu gestalten, hat eine Vielzahl von Ländern innerhalb und außerhalb Europas Zielbilder für die digitale Transformation ihrer Gesundheitssysteme entworfen und auf dieser Basis sogenannte eHealth-Strategien als Grundlage für zielgerichtete Maßnahmen geschaffen. Dies führt dort dazu, dass die Digitalisierung der Gesundheitssysteme schnell und erfolgreich voranschreitet (auf den vorderen Rängen Finnland, Estland, Dänemark), während das deutsche Gesundheitssystem in Erhebungen zum Digitalisierungsgrad, wie im aktuellen DESI-Index, regelmäßig schlecht abschneidet.
Deshalb brauchen wir auch für Deutschland ein eHealth-Zielbild mit einer daraus abgeleiteten eHealth-Strategie. Ein solches Zielbild gibt allen Beteiligten im Gesundheitssystem die notwendige Orientierung und ermöglicht es ihnen, konkrete Ziele zu definieren und zu erreichen.
Folge 8: Digitalisierung der Gesundheitswirtschaft führt zur individuellen Gesundheitsversorgung
Das deutsche Gesundheitswesen steht vor großen Herausforderungen: Der demografische Wandel und die Zunahme chronischer Erkrankungen erhöhen die Nachfrage nach Gesundheitsleistungen. Um eine flächendeckende, für jedermann zugängliche, qualitativ hochwertige und bezahlbare Versorgung künftig weiterhin sicherstellen zu können, muss die Digitalisierung der Gesundheitswirtschaft konsequent unterstützt werden.
Die Digitalisierung der Gesundheitswirtschaft führt zu einer individualisierten Gesundheitsversorgung - ausgerichtet an den Bedürfnissen und der Situationen des einzelnen Menschen - die innovativ, sektorenübergreifend, kontinuierlich, flexibel und vernetzt sowie zunehmend präventiv ist.
Über die Vernetzung medizinischer Geräte und Informationssysteme werden Versorgungsprozesse im Hintergrund optimiert und weitgehend automatisiert. Diese Prozesse werden mit digitalen Technologien der Versicherten (Apps, Wearables usw.) verknüpft, sodass ein wahrer „Datenschatz“ an indikations- und behandlungsbezogenen Daten sowie Informationen über individuelle Behandlungsfälle entsteht. Unter anderem können Big-Data-Analysen diese Daten auswerten und in Kombinationen mit anderen Daten der Versorgungsforschung eine Bewertung gegebenenfalls neuer Behandlungsansätze ermöglichen und dadurch medizinische Leitlinien aktualisieren oder neu aufsetzen.
Folge 7: Magisches Dreieck im Gleichgewicht: Schlüssel für erfolgreiche MedTech-Branche
Damit die Medizintechnik-Branche in Deutschland weiterhin innovativ sein und wachsen kann, ist ein gesundes Gleichgewicht zwischen Marktzugang, technischer Regulierung sowie Normen und Standards notwendig. Normen und Standards werden unter Beteiligung aller interessierten Kreise in einem definierten Prozess erarbeitet und veröffentlicht. Hingegen wird die technische Regulierung, aber auch der Marktzugang – also die Erstattung durch die gesetzlichen Krankenkassen – von der Politik beeinflusst. Zwischen diesen beiden Prozessen gilt es, ein Gleichgewicht zu finden, das innovationsfreundlich ist, aber auch die Sicherheit von Anwendern und Patienten im Auge hat. Ein solches Gleichgewicht stärkt die internationale Wettbewerbsfähigkeit der Medizintechnikbranche am Standort Deutschland.
Folge 6: Innovative Elektromedizin: Umsatz steigt kontinuierlich

Der Umsatz von innovativer Elektromedizin steigt kontinuierlich an und trägt damit zur dynamischen Wertschöpfung im Gesundheitsmarkt bei. Mit einem Gesamtumsatz der Elektromedizin in Höhe von 7,8 Milliarden Euro in 2009 auf 11,7 Milliarden Euro in 2017 bestätigt sich die weltweite Nachfrage nach modernster Elektromedizin aus Deutschland. Im Jahr 2017 betrug der Inlandsumsatz insgesamt 2,9 Milliarden Euro und der Auslandsumsatz 8,8 Milliarden Euro. Dabei erzielen Medizinprodukte aus dem Bereich der bildgebenden Diagnostik mit rund 70 Prozent den größten Teil des Umsatzes.
Umsätze | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 |
| Gesamtsamtumsatz in Mrd. € | 7,8 | 8,3 | 8,9 | 9,3 | 9,4 | 9,4 | 10,9 | 11,5 | 11,7 |
| Inlandsumsatz in Mrd. € | 2,1 | 2,1 | 1,9 | 1,9 | 1,9 | 1,9 | 2,4 | 2,9 | 2,9 |
| Auslandsumsatz in Mrd. € | 5,6 | 6,2 | 7,0 | 7,4 | 7,6 | 7,5 | 8,4 | 8,6 | 8,8 |
Folge 4: Die MedTech-Branche ist umsatzstark
Die Nachfrage von Medizintechnik ist weltweit sehr groß und steigt kontinuierlich an. So ist der Gesamtumsatz der Medizintechnik seit 2009 mit 20 Milliarden Euro auf 29,9 Milliarden Euro in 2017 angestiegen. Im Jahr 2017 betrug der Inlandsumsatz insgesamt 10,85 Milliarden Euro und der Auslandsumsatz 19,05 Milliarden Euro.
Umsätze | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 |
| Gesamtsamtumsatz in Mrd. € | 20 | 21,7 | 23,2 | 24,1 | 24,6 | 25,4 | 27,6 | 29,2 | 29,9 |
| Inlandsumsatz in Mrd. € | 7,5 | 7,8 | 7,8 | 7,7 | 7,9 | 9 | 10 | 10,6 | 10,85 |
| Auslandsumsatz in Mrd. € | 12,5 | 13,9 | 15,4 | 16,4 | 16,7 | 16,4 | 17,6 | 18,6 | 19,05 |
Folge 3: Deutschland ist drittgrößter MedTech-Produzent weltweit

Der Weltmarkt für Medizintechnologien betrug 2015 rund 320 Milliarden US Dollar. Mit einem Anteil von 38,8 Prozent waren die USA der größte Akteur auf internationaler Ebene. Dahinter folgt die Volksrepublik China mit 12,2 Prozent und auf dem dritten Platz Deutschland mit 9,3 Prozent der weltweiten Medizintechnikproduktion.
Folge 2: Die Gesundheitswirtschaft ist einer der größten Wirtschaftszweige in Deutschland
Mit einem Gesamtumsatz von 330 Milliarden Euro, Bruttowertschöpfung von 12% des Bruttoinlandprodukts (BIP) und gesamtdeutschen Exportquote von über 8% ist die Gesundheitswirtschaft einer der größten Wirtschaftszweige in Deutschland. Zur Gesundheitwirtschaft zählen stationäre (z.B. Krankenhäuser) sowie nicht-stationäre (z.B. Arztpraxen) Einrichtungen, die industrielle Gesundheitswirtschaft und die medizinische Versorgung, d.h. Apotheken.
Die MedTech-Branche ist dabei ein bedeutender Teil der industriellen Gesundheitswirtschaft. Mit einem Gesamtumsatz von 29,2 Milliarden Euro hat die Branche sich zu einem Kernstück der industriellen Gesundheitswirtschaft herauskristallisiert. Mit einer Bruttowertschöpfung von rund 3,9% und Exportquote in Höhe von 22,4% der deutschen Gesundheitswirtschaft leistet die MedTech-Branche einen hohen Beitrag am gesamtwirtschaftlichen Wohlstand und ist damit auch wesentlicher Bestandteil der Wertschöpfungskette Gesundheit.
Folge 1: Die Gesundheitswirtschaft schafft und sichert Arbeitsplätze
Die Gesundheitswirtschaft ist ein Arbeitsplatzmotor. Mit über 7 Millionen Beschäftigten und einem Anteil von 16,1 Prozent am gesamten deutschen Arbeitsmarkt gilt die Gesundheitswirtschaft als stabiler Faktor für sichere Arbeitsplätze.
Die MedTech-Branche ist dabei ein bedeutender Teil der industriellen Gesundheitswirtschaft. Neben rund 188.500 Erwerbstätigen sind weitere 220.600 Arbeitsplätze indirekt mit der MedTech-Branche verbunden. Die wirtschaftliche Aktivität der Branche hat damit einen überdurchschnittlichen hohen Ausstrahleffekt für den gesamten deutschen Arbeitsmarkt: Mit jedem Erwerbstätigen in der Gesundheitswirtschaft gehen 0,62 zusätzliche Arbeitsplätze in der Gesamtwirtschaft einher. In der MedTech-Branche sind es mit zusätzlichen 1,17 Beschäftigungsverhältnissen fast doppelt so viele.































